
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Скорость химической реакции равна изменению концентрации реагирующего вещества в единицу времени
|
|
|
|
Зависимость скорости химической реакции от температуры. Уравнение Аррениуса.
Различают среднюю скорость 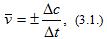
где Δс=с2-с1 – изменение концентрации вещества за промежуток времени Δt=t2-t1. Знак (+) означает, что вещество образуется, а знак (-) – что вещество расходуется в ходе реакции.
Основными факторами, определяющими скорость реакции, являются концентрация, температура и катализатор. Скорость реакций с участием газообразных реагентов зависит также от давления.
Зависимость скорости реакции от температуры. Для большинства реакций справедливо правило Вант-Гоффа: Повышение температуры на 10К увеличивает скорость большинства реакций в 2-4 раза:
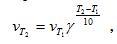 (3.9)
(3.9)
где 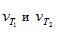 - скорости реакции при Т1 и Т2; γ – термический коэффициент скорости химической реакции
- скорости реакции при Т1 и Т2; γ – термический коэффициент скорости химической реакции 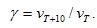
Молекулы газов и жидкостей испытывают ежесекундно огромное число столкновений. Только очень малая доля столкновений заканчивается химическими превращениями. Такие столкновения называются эффективными соударениями. Молекулы - активными молекулами с большей энергией. Избыточная энергия необходима молекулам для преодоления сил отталкивания внешних электронных оболочек и для образования активированного комплекса, т.е. промежуточного соединения между исходными веществами и конечными продуктами. В активированном комплексе старые связи еще не полностью разрушены, а новые еще не полностью образовались.

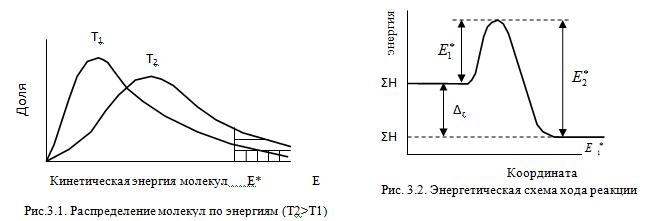
Изменение энергии в ходе химической реакции показано схемой процесса активации (рис.3.2). По оси ординат отложена потенциальная энергия системы. Абсцисса - координата реакции или реакционного пути. В процессе химического превращения переход системы из начального состояния с энергией ΣНi в конечное состояние с ΣНf происходит через энергетический барьер 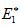
Энергия активации (Е*) - это энергия, необходимая для перевода в состояние активированного комплекса 1 моль реагирующих веществ. Разность ΣНf - ΣНi составляет тепловой эффект реакции (ΔrH). Для обратной реакции тепловой эффект будет иметь ту же величину, но противоположный знак. Для обратной реакции энергия активации составит величину. 
Зависимость константы скорости химической реакции от температуры описывается уравнением Аррениуса:  (3.10)
(3.10)
где k – константа скорости реакции; ko – константа, зависящая от природы реагирующих веществ; Е* - энергия активации; R – универсальная газовая постоянная; Т – температура, К. Константа скорости, а следовательно и скорость химической реакции экспоненциально растет с увеличением температуры.
|
|
|
|
|
Дата добавления: 2014-12-24; Просмотров: 518; Нарушение авторских прав?; Мы поможем в написании вашей работы!