
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Введение. 9 Лабораторна робота: Розрахунок кінетичних параметрів
|
|
|
|
Висновки
Результати
9 Лабораторна робота:
Розрахунок кінетичних параметрів
Мета роботи: дослідження ступеня окислення оксиду вуглецю (II) залежно від виду каталізатора, температури, надлишку повітря та об’ємної швидкості газового потоку.
Вихідні дані:
Приймаємо початкову концентрацію СО рівною одиниці, тобто  .
.
Витрата оксиду вуглецю (II) RCO = 15,7 см3/хв згідно з капіляром К2;
Витрата повітря Rпов = 118 см3/хв згідно з капіляром К1;
Діаметр сітчастого каталізатора 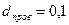 мм;
мм;
Висота покриття 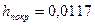 мм.
мм.
Каталітичне окиснення оксиду вуглецю (II) до оксиду (IV) за рівнянням:
2СО + О2 = 2СО2 + Q
Розрахунок:
Визначається висота проволоки з нанесеним каталізатором:
 , (9.1)
, (9.1)
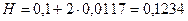 мм
мм
Знаходимо площу каталізатора:
 , (9.2)
, (9.2)
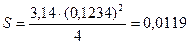 мм2.
мм2.
Визначається об’єм каталізатора на 1-ій, 2-ій, 3-ій, 4-ій сітках:
 , (9.3)
, (9.3)
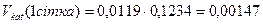 мм3;
мм3;
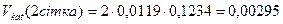 мм3;
мм3;
 мм3;
мм3;
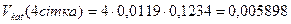 мм3.
мм3.
Визначається час контактування τ на кожній сітці:
 , (9.4)
, (9.4)
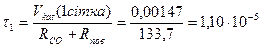 с;
с;
 с;
с;
 с;
с;
 с.
с.
Таблиця 9.1 – Результати дослідів для Pt каталізатора
| Витрати повітря, Rпов, см3/хв | Витрати газової суміші, RCO+N2, см3/хв | Сумарні витрати, см3/хв | Температура реактора, Тр, ˚С | Вміст СО у вихідній суміші, Споч, % | Вміст СО у суміші після окислення, Скін, % | Ступінь конверсії, Х, % |
| 15,7 | 133,7 | 1,1 | 1,1 | |||
| 15,7 | 133,7 | 1,1 | 1,1 | |||
| 15,7 | 133,7 | 1,1 | 1,1 | |||
| 15,7 | 133,7 | 1,1 | 0,9 | 18,18 | ||
| 15,7 | 133,7 | 1,1 | 0,7 | 36,36 | ||
| 15,7 | 133,7 | 1,1 | 0,6 | 45,45 | ||
| 15,7 | 133,7 | 1,1 |
Із таблиці 9.1 виписуємо значення ступеня конверсії при температурах 220˚С і 260˚С (значення температури вибирається із середини діапазону):
t1 = 220˚С x1 = 0,18;
t2 = 260˚С x2 = 0,45.
Формула, яка пов’язує ступінь конверсії х, час τ та константу швидкості k:
 (9.5)
(9.5)
Використовуючи формулу 5, розраховуємо значення константи швидкості при двох температурах та за час контактування на першій сітці:
 ;
;
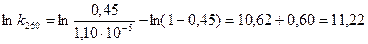 .
.
|
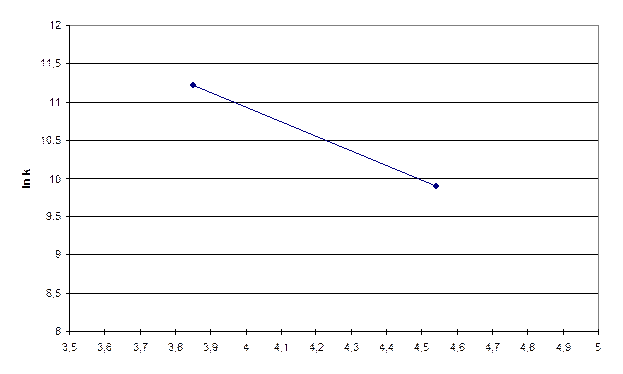
Рисунок 9.2 – Графік залежності lnk від 
Із рисунка 9.2 визначаємо значення  :
:
 ;
;
Формула, яка зв’язує тангенс кута нахилу з енергією активації:
 (9.6)
(9.6)
Використовуючи формулу 9.6, знаходимо значення енергії активації:
 кДж ≈ 40 кДж.
кДж ≈ 40 кДж.
При 220˚С початкова концентрація СО складає:
С01 = 0,5; С02 = 0,6; С03 = 0,8; С04 = 1.
Таблиця 9.2 – Ступінь конверсії х, характерний для певної початкової концентрації СО при 220˚С
| Початкова концентрація СО | Ступінь конверсії, частки | |||
| х1 | х2 | х3 | х4 | |
| 0,12 | 0,38 | 0,57 | 0,62 | |
| 0,8 | 0,23 | 0,49 | 0,67 | 0,72 |
| 0,6 | 0,37 | 0,64 | 0,8 | 0,84 |
| 0,5 | 0,48 | 0,74 | 0,89 | 0,93 |
Для побудови рисунка 9.3 використовуємо дані, наведені в таблиці 9.2.
|
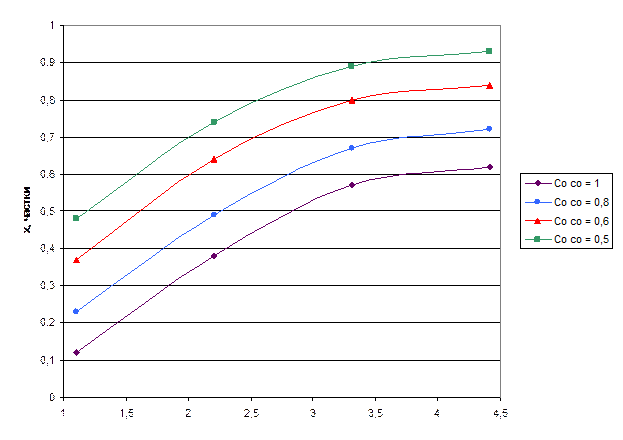
Рисунок 9.3 – Графік залежності ступені конверсії х від часу контактування на сітці τ
Щоб визначити порядок реакції використаємо два способи:
I спосіб:
Із рисунка 9.3 визначаємо тангенси кута нахилу при різних ступенях конверсії:
 ;
;
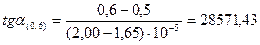 ;
;

 ;
;
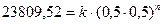 ;
;
 ;
;

 ;
;
 ;
;
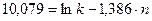 ;
;
 ;
;
Віднявши від першого рівняння друге отримаємо:
 ;
;
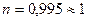 .
.
II спосіб:
Формула для визначення швидкості реакції:
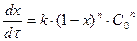 (9.7)
(9.7)
Визначається значення константи швидкості при 220˚С:
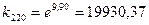
Використовуючи формулу 9.7, знайдемо значення порядку реакції:
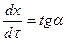 ;
;
 ;
;
 ;
;
 .
.
Отже, порядок реакції 1 перший, енергія активації складає 40 кДж.
Кінетичне рівняння має наступний вигляд:
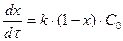 .
.
1.1. История возникновения и развития дисциплин по учёту человеческого фактора
|
|
|
|
|
Дата добавления: 2014-12-25; Просмотров: 354; Нарушение авторских прав?; Мы поможем в написании вашей работы!
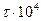 , с
, с