
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термодинамічний процес (незамкнутий цикл)
|
|
|
|
· Розглянемо оборотній цикл 1a2b1, в якому 1a2 – оборотній процес і 2b1 – теж оборотній процес (рис. 6.8). Для оборотнього циклу запишемо інтеґрал Клаузіуса:


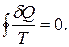 (6.75)
(6.75)
Рис. 6.8. Схема циклу для означення термодинамічних процесів
Розіб’ємо цей інтеґрал на частини:

 (6.76)
(6.76)
і представимо вираз (6.76) у вигляді:

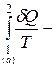
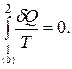 (6.77)
(6.77)
Тоді

 . (6.78)
. (6.78)
За означенням інтеґрал (6.78) є зміна ентропії в кінцевому процесі 1→2:
 (S2 – S1). (6.79)
(S2 – S1). (6.79)
· Висліди з (6.79):
1) зведене тепло 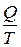 для оборотнього процесу є параметром термодинамічного стану;
для оборотнього процесу є параметром термодинамічного стану;
2) при адіабатному процесі (δQ=0)
(S2 – S1)= ΔS= 0 (6.80)
тобто для ізольованої системи зміна ентропії в оборотньому процесі дорівнює нулю;
3) при ізотермному процесі (Т=const)
 (6.81)
(6.81)
· Нехай цикл 1a2b1 необоротній (рис. 6.8), при цьому процес 1a2 – необоротній, а 2b1 – оборотній.
Запишемо другий інтеґрал Клаузіуса для необоротнього циклу:
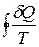 <0. (6.82)
<0. (6.82)
Розіб’ємо (6.82) на два інтеґрали:

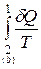 <0 (6.83)
<0 (6.83)
і представимо вираз (6.83) у вигляді:
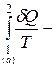
 <0. (6.84)
<0. (6.84)
Звідки
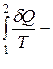 (S2 – S1) <0, (6.85)
(S2 – S1) <0, (6.85)
 <(S2 – S1). (6.86)
<(S2 – S1). (6.86)
· Висліди з (6.86):
1) зведене тепло 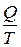 для необоротнього процесу не є параметром термодинамічного стану;
для необоротнього процесу не є параметром термодинамічного стану;
2) при адіабатному процесі (δQ=0)
(S2 – S1)>0 – принцип зростання ентропії в ізольованій системі;
3) таким чином, для ізольованої системи зростання ентропії визначає напрямок самочинного процесу і досягнення рівноваги при
(S2 – S1)≥0; (6.87)
і у цьому полягає фізичний смисл ентропії;
4) при ізотермному процесі (Т=const)
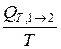 < (S2 – S1); (6.88)
< (S2 – S1); (6.88)
5) різниця
Δ=(S2 – S1) – 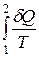 (6.89)
(6.89)
визначає ступінь відхилення необоротнього процесу від оборотнього і в цьому полягає термодинамічний смисл ентропії.
|
|
|
|
|
Дата добавления: 2014-12-25; Просмотров: 576; Нарушение авторских прав?; Мы поможем в написании вашей работы!