
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ізохорно-ізотермний потенціал Гельмгольца
|
|
|
|
Із врахуванням другого начала термодинаміки, першої форми запису першого начала термодинаміки та лише термодинамічної роботи рівняння для нерівновагових процесів запишемо так:
TdS ³ dU + pdV. (7.22)
Враховуючи, що TdS = d(TS) – SdT,
рівняння (7.22) запишемо так:
d(TS) – SdT ³ dU+ pdV, (7.23)
звідки – SdT – pdV ≥ dU – d(TS). (7.24)
Зрозуміло, що
dU – d(TS) = d (U – TS). (7.25)
Тоді вираз (7.24) набуде вигляду:
– SdT – pdV ≥ d (U – TS).
Термодинамічну функцію F=(U – TS) називають ізохорно-ізотермним потенціалом (ізохорним потенціалом, потенціалом Гельмгольца, гельмгольцівським потенціалом, «вільною енергією»*, «енергією Гельмгольца»*, гельмгольцівською «енергією»*, «вільною енергією» при сталому об’ємі* тощо):
F = U – TS, (7.26)
 * Терміни «вільна енергія», «енергія Гельмгольца», «гельмгольцівська енергія», «вільна енергія при сталому об’ємі» є некоректними і можуть викликати помилкове уявлення про існування особливої форми енергії. В дійсности це данина історії науки і ніякої особливої форми енергії, що відповідає термодинамічному ізохорно-ізотермному потенціалу F, в тілі не існує.
* Терміни «вільна енергія», «енергія Гельмгольца», «гельмгольцівська енергія», «вільна енергія при сталому об’ємі» є некоректними і можуть викликати помилкове уявлення про існування особливої форми енергії. В дійсности це данина історії науки і ніякої особливої форми енергії, що відповідає термодинамічному ізохорно-ізотермному потенціалу F, в тілі не існує.
де (TS) – зв’язана частина внутрішньої енергії, яка в ізохорно-ізотермній системі при ізохорно-ізотермних процесах не може бути перетворена в роботу.
Повним диференціалом функції F є
dF = dU – TdS – SdT. (7.27)
Записавши (7.26) так
U = F + (TS), (7.28)
враховуючи, що в ізохорно-ізотермній системі робота може бути звершена тільки за рахунок зменшення F, можна стверджувати, що в такій системі в роботу може бути перетворена не вся внутрішня енергія, а тільки її «вільна» частина F.
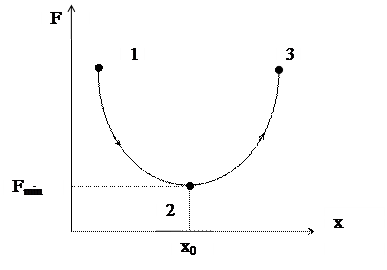 |
Рис. 7.2. Самочинні (1→2) і несамочинні (2→3) процеси в системах при V,Т=const (тут х – хід процесу)
Таким чином, рівняння (7.24) для нерівновагових процесів запишемо так:
– SdT – pdV ≥ dF. (7.29)
Звідки витікає, що критерієм рівноваги системи, для якої V, T = const (ізохорно-ізотермна система), є умови:
dF £ 0, (7.30)
тобто, з наближенням до стану рівноваги ізохорно-ізотермний потенціал зменшується, досягаючи мінімуму у стані рівноваги. Таким чином, у стані рівноваги:
F = Fmin; dF = 0; d2F > 0 (мінімум F). (7.31)
Таким чином, самочинні процеси, які відбуваються при умовах V, T=const, можливі лише у напрямку зменшення F і їх границею, тобто умовою рівноваги, є досягнення мінімального значення F (рис. 7.2). При цих же умовах можливі процеси при dF > 0, але вони є несамочинними і вимагають витрат енергії.
На підставі (7.26) запишемо при T = const:
ΔF = ΔU – TΔS, тобто ΔU= ΔF+ TΔS, (7.32)
де ΔU – ізохорний тепловий ефект;
ТΔS – ентропійний фактор.
На підставі рівняння (7.29) для рівновагових процесів запишемо:
– SdT – pdV = dF, (7.33)
звідки
· при V=const 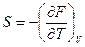 ; (7.34)
; (7.34)
· при Т=const 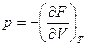 . (7.35)
. (7.35)
|
|
|
|
|
Дата добавления: 2014-12-25; Просмотров: 524; Нарушение авторских прав?; Мы поможем в написании вашей работы!