
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Соединения серы
Сульфаты. Сульфаты присутствуют практически во всех поверхностных водах и являются одними из важнейших анионов. Главным источником сульфатов в поверхностных водах являются процессы химического выветривания и растворения серосодержащих минералов, в основном гипса, а также окисления сульфидов и серы:
2FeS2 + 7O2 + 2H2O = 2FeSO4 + 2H2SO4;
2S + 3O2 + 2H2O = 2H2SO4.
Значительные количества сульфатов поступают в водоемы в процессе отмирания организмов, окисления наземных и водных веществ растительного и животного происхождения и с подземным стоком. В больших количествах сульфаты содержатся в шахтных водах и в промышленных стоках производств, в которых используется серная кислота, например, окисление пирита. Сульфаты выносятся также со сточными водами коммунального хозяйства и сельскохозяйственного производства.
Ионная форма SO42- характерна только для маломинерализованных вод. При увеличении минерализации сульфатные ионы склонны к образованию устойчивых ассоциированных нейтральных пар типа CaSO4, MgSO4.
Содержание сульфатных ионов в растворе ограничивается сравнительно малой растворимостью сульфата кальция (произведение растворимости сульфата кальция L=6,1·10-5). При низких концентрациях кальция, а также в присутствии посторонних солей концентрация сульфатов может значительно повышаться.
Сульфаты активно участвуют в сложном круговороте серы. При отсутствии кислорода под действием сульфатредуцирующих бактерий они восстанавливаются до сероводорода и сульфидов, которые при появлении в природной воде кислорода снова окисляются до сульфатов. Растения и другие автотрофные организмы извлекают растворенные в воде сульфаты для построения белкового вещества. После отмирания живых клеток гетеротрофные бактерии освобождают серу протеинов в виде сероводорода, легко окисляемого до сульфатов в присутствии кислорода.
| Концентрация сульфата в природной воде изменяется в широких пределах. В речных водах и в водах пресных озер содержание сульфатов часто колеблется от 5-10 до 60 мг/дм3, в дождевых водах – от 1 до 10 мг/дм3. В подземных водах содержание сульфатов может достигать значительно больших величин. |
Концентрация сульфатов в поверхностных водах подвержена заметным сезонным колебаниям и обычно коррелирует с изменением общей минерализации воды. Важнейшим фактором, определяющим режим сульфатов, является меняющееся соотношение между поверхностным и подземным стоками. Заметное влияние оказывают окислительно-восстановительные процессы, биологическая обстановка в водном объекте и хозяйственная деятельность человека.
| Повышенное содержание сульфатов ухудшает органолептические свойства воды и оказывают физиологическое воздействие на организм человека. Поскольку сульфат обладает слабительными свойствами, его предельно допустимая концентрация строго регламентируется нормативными актами. Весьма жесткие требования по содержанию сульфатов предъявляются к водам, питающим паросиловые установки, поскольку сульфаты в присутствии кальция образуют прочную накипь. Вкусовой порог сульфата магния лежит в пределах от 400 до 600 мг/дм3, для сульфата кальция — от 250 до 800 мг/дм3. |
ПДК сульфатов в воде водоемов хозяйственно-питьевого назначения составляет 500 мг/дм3, лимитирующий показатель вредности – органолептический.
Не замечено, чтобы сульфат в питьевой воде влиял на процессы коррозии, но при использовании свинцовых труб концентрация сульфатов выше 200 мг/дм3 может привести к вымыванию в воду свинца.
Сульфаты – распространенные компоненты природных вод. Их присутствие в воде обусловлено растворением некоторых минералов – природных сульфатов (гипс), а также переносом с дождями содержащихся в воздухе сульфатов. Последние образуются при реакциях окисления в атмосфере оксида серы (IV) до оксида серы (VI), образования серной кислоты и ее нейтрализации (полной или частичной):
2SО2 + О2 = 2SО3,
SО3 + Н2О = Н2SО4.
Наличие сульфатов в промышленных сточных водах обычно обусловлено технологическими процессами, протекающими с использованием серной кислоты (производство минеральных удобрений, производства химических веществ). Сульфаты в питьевой воде не оказывают токсического эффекта для человека, однако ухудшают вкус воды: ощущение вкуса сульфатов возникает при их концентрации 250-400 мг/л. Сульфаты могут вызывать отложение осадков в трубопроводах при смешении двух вод с разным минеральным составом, например, сульфатных и кальциевых, в осадок выпадает СаSО4.
Метод определения массовой концентрации сульфат-аниона основан на реакции сульфат-анионов с катионами бария с образованием нерастворимой суспензии сульфата бария по реакции:
Ва2 + SО42- = ВаSО4.
О концентрации сульфат-анионов судят по количеству суспензии сульфата бария, которое определяют турбидиметрическим методом. Предлагаемый, наиболее простой вариант турбидиметрического метода основан на измерении высоты столба суспензии по его прозрачности и применим при концентрации сульфат-анионов не менее 30 мг/л.
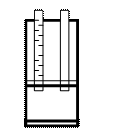
Анализ выполняют в прозрачной воде (при необходимости воду фильтруют). Для работы необходим мутномер – несложное приспособление, которое может быть изготовлено и самостоятельно (см. рис.).
|
|
Дата добавления: 2014-12-26; Просмотров: 597; Нарушение авторских прав?; Мы поможем в написании вашей работы!