
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Выполнение анализа
|
|
|
|
Оборудование и реактивы
Пипетка на 2 мл или на 5 мл с резиновой грушей (медицинский шприц) и соединительной трубкой; пипетка-капельница, склянка с меткой «10 мл» с пробкой.
Раствор нитрата серебра (0,05 г-экв/л) титрованный, раствор хромата калия (10 %).
О приготовлении растворов см. приложение 3.
1. В склянку налейте 10 мл анализируемой воды.
2. Добавьте в склянку пипеткой-капельницей 3 капли раствора хромата калия.
3. Герметично закройте склянку пробкой и встряхните, чтобы перемешать содержимое.
4. Постепенно титруйте содержимое склянки раствором нитрата серебра при перемешивании до появления неисчезающей бурой окраски. Определите объем раствора, израсходованный на титрование (Vхл, мл).
5. Рассчитайте массовую концентрацию хлорид-аниона (Схл, мг/л) по формуле: Схл=Vхл • 178. Результат округлите до целых чисел.
Активный хлор. Хлор, присутствующий в воде в виде хлорноватистой кислоты или иона гипохлорита, принято называть свободным хлором. Хлор, существующий в виде хлораминов (моно- и ди-), а также в виде треххлористого азота, называют связанным хлором. Общий хлор – это сумма свободного и связанного хлора.
В промышленности хлор используют при отбеливании в бумажном производстве, производстве ваты, для уничтожения паразитов в холодильных установках и т.д. При растворении хлора в воде образуются соляная и хлорноватистая кислоты:
Cl2 + H2O Û H+ + Cl- + HClO.
В зависимости от условий, таких как pH, температура, количество органических примесей и аммонийного азота, хлор может присутствовать и в других формах, включая ион гипохлорита (OCl-) и хлорамины.
Активный хлор должен отсутствовать в воде водоемов, лимитирующий показатель вредности – общесанитарный.
Хлор может находиться в воде не только в составе хлоридов, но и в составе других соединений, обладающих сильными окислительными свойствами. К таким соединениям хлора относятся свободный хлор (С12), гипохлорит-анион (СlO-), хлорноватистая кислота (НСO), хлорамины (вещества, при растворении в воде которых образуются монохлорамин NН2С1, дихлорамин NНС12, трихлорамин NС13). Суммарное содержание этих соединений называют термином «активный хлор». Содержащие активный хлор вещества подразделяют на две группы: сильные окислители – хлор, гипохлориты и хлорноватистая кислота – содержат так называемый «свободный активный хлор», и относительно менее слабые окислители – хлорамины – «связанный активный хлор». Благодаря сильным окислительным свойствам соединения, имеющие активный хлор, используются для обеззараживания (дезинфекции) питьевой воды и воды в бассейнах, а также для химической очистки некоторых сточных вод. Кроме того, некоторые содержащие активный хлор соединения (например, хлорная известь) широко используются для ликвидации очагов распространения инфекционных загрязнений. Наиболее широко для дезинфекции питьевой воды используется свободный хлор.
В природной воде содержание активного хлора не допускается; в питьевой воде его содержание установлено в пересчете на хлор на уровне 0,3-0,5 мг/л в свободном виде и на уровне 0,8-1,2 мг/л в связанном виде. Активный хлор в указанных концентрациях присутствует в питьевой воде непродолжительное время (не более нескольких десятков минут) и нацело удаляется даже при кратковременном кипячении воды. По этой причине анализ отобранной пробы на содержание активного хлора следует проводить немедленно.
Интерес к контролю содержания хлора в воде, особенно в питьевой воде, возрос после осознания того факта, что хлорирование воды приводит к образованию заметных количеств хлоруглеводородов, вредных для здоровья населения. Особую опасность представляет хлорирование питьевой воды, загрязненной фенолом. ПДК для фенолов в питьевой воде при отсутствии хлорирования питьевой воды установлена 0,1 мг/л, а в условиях хлорирования (при этом образуются гораздо более токсичные и имеющие резкий характерный запах хлорфенолы) – 0,001 мг/л. Аналогичные химические реакции могут протекать с участием органических соединений природного или техногенного происхождения, приводя к различным токсичным хлорорганическим соединениям – ксенобиотикам.
Предлагаемый йодометрический метод основан на свойстве всех содержащих активный хлор соединений в кислой среде выделять из йодида калия свободный йод:
С12+2I-=I2+2Сl-
С1О-+2Н++2I-=I2+Сl-+Н2О
НС1О+Н++2I-=I2+ Сl-+Н2О
NН2С1+2Н++2I-=I2+NН4++ Сl-
Свободный йод оттитровывают тиосульфатом натрия в присутствии крахмала как описано при определении растворенного кислорода. Реакцию проводят в буферном растворе при рН 4,5, и тогда определению не мешают нитриты, озон и другие соединения. Однако мешающими определению веществами являются другие сильные окислители, которые также выделяют йод из йодида калия – хроматы, хлораты и др. Концентрации, в которых указанные окислители оказывают мешающее действие, могут присутствовать в сточных водах, но маловероятны в питьевой и природной воде. Метод может использоваться для анализа также мутных и окрашенных вод.
Концентрацию активного хлора (САХ) в мг/л рассчитывают по результатам титрования, для которого обычно используется раствор тиосульфата натрия с концентрацией 0,005 г-экв/л. Расчет проводят по формуле:
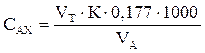 ,
,
где VT – количество раствора тиосульфата натрия с концентрацией 0,005 г-экв/л, израсходованного на титрование, мл; К – поправочный коэффициент, учитывающий отклонение точной фактической концентрации тиосульфата от значения 0,005 г-экв/л (для большинства случаев значение К принимается равным 1); 0,177 – содержание активного хлора в мг, соответствующее 1 мл раствора тиосульфата с концентрацией
0,005 г-экв/л; VA – объем пробы воды, взятой для анализа, мл; 1000 – коэффициент пересчета единиц измерения из миллилитров в литры.
Чувствительность метода – 0,3 мг/л при объеме пробы 250 мл, однако при использовании растворов тиосульфата с различной концентрацией объем пробы может составлять, в зависимости от требуемой чувствительности определения, от 500 до 50 мл воды и менее. Лимитирующий показатель вредности для активного хлора – общесанитарный.
|
|
|
|
|
Дата добавления: 2014-12-26; Просмотров: 1118; Нарушение авторских прав?; Мы поможем в написании вашей работы!