
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворенный кислород
|
|
|
|
Коэффициенты пересчета концентраций из мг/л в мг-экв/л
Контроль точности анализа
Выполнение определения
1. Налейте в колориметрическую пробирку анализируемую воду до метки (5 мл).
2. Добавьте содержимое одной капсулы (около 0,1 г) буферной смеси. Перемешайте пробирку встряхиванием до растворения смеси (до рН 5).
3. Добавьте с помощью шприца с наконечником-пипеткой 2,0 мл лантанализаринкомплексонового лака, после чего смесь снова перемешайте.
4.Оставьте смесь на 20 мин. для завершения реакции.
5.Окраску раствора в склянке сравните на белом фоне с контрольной шкалой образцов окраски.
В случае, если окраска пробы окажется интенсивнее образца
«2,0 мг/л», анализируемую воду разбавьте в 2-5 раз дистиллированной водой и определение повторите. При вычислении результата учтите величину разбавления пробы.
Контроль точности анализа при определении фторидов проводят с использованием контрольных растворов с известным содержанием фторид-аниона (см. приложение 1) либо с использованием поверенного (образцового) ионселективного электрода потенциометрическим методом.
Общее солесодержание. Для расчета общего солесодержания по сумме концентраций главных анионов в миллиграмм-эквивалентной форме их массовые концентрации, определенные при анализе и выраженные в мг/л, умножьте на коэффициенты, указанные в табл. 14, после чего просуммируйте (ГОСТ 1030).
Таблица 14
| Анионы | Коэффициент |
| Гидрокарбонат | 0,0164 |
| Карбонат | 0,0333 |
| Хлорид | 0,0282 |
| Сульфат | 0,0208 |
| Нитрат | 0,0161 |
| Нитрит | 0,0217 |
Концентрацию катиона калия в данном расчете (для природных вод) условно учитывают в виде концентрации катиона натрия. Полученный результат округлите до целых чисел (мг-экв/л).
Растворенный кислород находится в природной воде в виде молекул O2. На его содержание в воде влияют две группы противоположно направленных процессов: одни увеличивают концентрацию кислорода, другие уменьшают ее. К первой группе процессов, обогащающих воду кислородом, следует отнести:
· процесс абсорбции кислорода из атмосферы;
· выделение кислорода водной растительностью в процессе фотосинтеза;
· поступление в водоемы с дождевыми и снеговыми водами, которые обычно пересыщены кислородом.
Абсорбция кислорода из атмосферы происходит на поверхности водного объекта. Скорость этого процесса повышается с понижением температуры, с повышением давления и понижением минерализации. При каждом значении температуры существует равновесная концентрация кислорода, которую можно определить по специальным справочным таблицам, составленным для нормального атмосферного давления. Аэрация – обогащение глубинных слоев воды кислородом – происходит в результате перемешивания водных масс, в том числе ветрового, вертикальной температурной циркуляции и т.д.
Фотосинтетическое выделение кислорода происходит при ассимиляции диоксида углерода водной растительностью (прикрепленными, плавающими растениями и фитопланктоном). Процесс фотосинтеза протекает тем сильнее, чем выше температура воды, интенсивность солнечного освещения и больше биогенных (питательных) веществ (P, N и др.) в воде. Продуцирование кислорода происходит в поверхностном слое водоема, глубина которого зависит от прозрачности воды (для каждого водоема и сезона может быть различной, от нескольких сантиметров до нескольких десятков метров).
К группе процессов, уменьшающих содержание кислорода в воде, относятся реакции потребления его на окисление органических веществ: биологическое (дыхание организмов), биохимическое (дыхание бактерий, расход кислорода при разложении органических веществ) и химическое (окисление Fe2+, Mn2+, NO2-, NH4+, CH4, H2S). Скорость потребления кислорода увеличивается с повышением температуры, количества бактерий и других водных организмов и веществ, подвергающихся химическому и биохимическому окислению. Кроме того, уменьшение содержания кислорода в воде может происходить вследствие выделения его в атмосферу из поверхностных слоев и только в том случае, если вода при данных температуре и давлении окажется пересыщенной кислородом.
| В поверхностных водах содержание растворенного кислорода варьирует в широких пределах – от 0 до 14 мг/дм3 – и подвержено сезонным и суточным колебаниям. Суточные колебания зависят от интенсивности процессов его продуцирования и потребления и могут достигать 2,5 мг/дм3 растворенного кислорода. В зимний и летний периоды распределение кислорода носит характер стратификации. Дефицит кислорода чаще наблюдается в водных объектах с высокими концентрациями загрязняющих органических веществ и в эвтрофированных водоемах, содержащих большое количество биогенных и гумусовых веществ. |
Концентрация кислорода определяет величину окислительно-восстановительного потенциала и в значительной мере направление и скорость процессов химического и биохимического окисления органических и неорганических соединений. Кислородный режим оказывает глубокое влияние на жизнь водоема. Минимальное содержание растворенного кислорода, обеспечивающее нормальное развитие рыб, составляет около 5 мг/дм3. Понижение его до 2 мг/дм3 вызывает массовую гибель (замор) рыбы. Неблагоприятно сказывается на состоянии водного населения и пересыщение воды кислородом в результате процессов фотосинтеза при недостаточно интенсивном перемешивании слоев воды.
| В соответствии с требованиями к составу и свойствам воды водоемов у пунктов питьевого и санитарного водопользования содержание растворенного кислорода в пробе, отобранной до 12 часов дня, не должно быть ниже 4 мг/дм3 в любой период года; для водоемов рыбохозяйственного назначения концентрация растворенного в воде кислорода не должна быть ниже 4 мг/дм3 в зимний период (при ледоставе) и 6 мг/дм3 – в летний. |
Определение кислорода в поверхностных водах включено в программы наблюдений с целью оценки условий обитания гидробионтов, в том числе рыб, а также как косвенная характеристика оценки качества поверхностных вод и регулирования процесса очистки стоков (табл. 15). Содержание растворенного кислорода существенно для аэробного дыхания и является индикатором биологической активности (т.е. фотосинтеза) в водоеме.
Таблица 15
Содержание кислорода в водоемах с различной степенью загрязненности
| Уровень загрязненности воды и класс качества | Растворенный кислород | ||
| лето, мг/дм3 | зима, мг/дм3 | % насыщения | |
| Очень чистые, I | 14–13 | ||
| Чистые, II | 12–11 | ||
| Умеренно загрязненные, III | 7–6 | 10–9 | |
| Загрязненные, IV | 5–4 | 5–4 | |
| Грязные, V | 3–2 | 5–1 | |
| Очень грязные, VI |
Относительное содержание кислорода в воде, выраженное в процентах его нормального содержания, называется степенью насыщения кислородом.
Эта величина зависит от температуры воды, атмосферного давления и солености. Вычисляется по формуле:
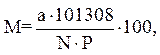
где M – степень насыщения воды кислородом, %;
а – концентрация кислорода, мг/дм3;
Р – атмосферное давление в данной местности, Па;
N – нормальная концентрация кислорода при данной температуре, минерализации (солености) и общем давлении 101308 Па.
Растворенный кислород (РК) является весьма неустойчивым компонентом химического состава вод. При его определении особо тщательно следует проводить отбор проб: необходимо избегать контакта воды с воздухом до фиксации кислорода (связывания его в нерастворимое соединение).
В ходе анализа воды определяют концентрацию РК (в мг/л) и степень насыщения им воды (в %) по отношению к равновесному содержанию при данных температуре и атмосферном давлении.
Контроль содержания кислорода в воде – чрезвычайно важная проблема, в решении которой заинтересованы практически все отрасли народного хозяйства, включая черную и цветную металлургию, химическую промышленность, сельское хозяйство, медицину, биологию, рыбную и пищевую промышленность, службы охраны окружающей среды. Содержание РК определяют как в незагрязненных природных водах, так и в сточных водах после очистки. Процессы очистки сточных вод всегда сопровождаются контролем содержания кислорода. Определение РК является частью анализа при определении другого важнейшего показателя качества воды – биохимического потребления кислорода (БПК).
Определение концентрации РК в воде проводится методом йодометрического титрования – методом Винклера, широко используемым и общепринятым при санитарно-химическом и экологическом контроле. Метод определения концентрации РК основан на способности гидроксида марганца (II) окисляться в щелочной среде до гидроксида марганца (IV), количественно связывая при этом кислород. В кислой среде гидроксид марганца (IV) снова переходит в двухвалентное состояние, окисляя при этом эквивалентное связанному кислороду количество йода. Выделившийся йод оттитровывают раствором тиосульфата натрия в присутствии крахмала в качестве индикатора.
Определение РК проводится в несколько этапов. Сначала в анализируемую воду добавляют соль Мn(II), который в щелочной среде реагирует с растворенным кислородом с образованием нерастворимого дегидратированного гидроксида Мn(IV) по уравнению:
2Мп2+ + О2 + 4ОН- = 2МnО(ОН)2
Таким образом производится фиксация, т.е. количественное связывание, кислорода в пробе. Фиксация РК, являющегося неустойчивым компонентом в составе воды, должна быть проведена сразу после отбора пробы.
Далее к пробе добавляют раствор сильной кислоты (как правило, соляной или серной) для растворения осадка, и раствор йодида калия, в результате чего протекает химическая реакция с образованием свободного йода по уравнению:
МnО(ОН)2 + 2J- + 4Н+ = Мn2++ J2+3Н2О
Затем свободный йод титруют раствором тиосульфата натрия в присутствии крахмала, который добавляют для лучшего определения момента окончания титрования. Реакции описываются уравнениями:
J2 + 2S2О32- = 2 J- + S4О62-
J2 + крахмал Þ синее окрашивание
О завершении титрования судят по исчезновению синей окраски (обесцвечиванию) раствора в точке эквивалентности. Количество раствора тиосульфата натрия, израсходованное на титрование, пропорционально концентрации растворенного кислорода.
В сточных и загрязненных поверхностных водах могут присутствовать компоненты, искажающие результаты определения РК методом Винклера. К таким компонентам относятся следующие загрязняющие вещества.
1. Взвешенные и окрашенные вещества. Они могут помешать определению, адсорбируя йод на своей поверхности или химически взаимодействуя с ним. При наличии в анализируемой воде взвешенных веществ их отделяют отстаиванием (не фильтрованием!) либо осветлением при добавлении раствора алюмокалиевых квасцов и аммиака.
2. Биологически активные взвешенные вещества (например, активный ил биохимических очистных сооружений). Пробы сточных вод, содержащие плохо оседающие взвешенные вещества, которые могут вызвать снижение концентрации кислорода вследствие продолжающейся жизнедеятельности микроорганизмов, необходимо осветлять также прибавлением раствора алюмокалиевых квасцов при одновременном добавлении токсичного для микроорганизмов вещества (растворов сульфаминовой кислоты, хлорида ртути или сульфата меди) сразу после отбора пробы.
3. Восстановители, реагирующие с выделенным йодом в кислой среде (сульфиты, тиосульфаты, сульфиды). Для устранения влияния восстановителей используют метод Росса, основанный на добавках к пробам растворов гипохлорита натрия NаОС1, хлорной извести СаОС12 и роданида калия КNСS.
4. Окислители,выделяющие йод из йодида калия (активный хлор, нитриты, катионы железа (III) и др.). Влияние железа (III) устраняется добавлением раствора фторида калия.
Влияние нитритов,которые часто встречаются в природных и сточных водах, устраняют добавлением раствора сульфаниловой кислоты, обычно предусмотренного в измерительных комплектах.
|
|
|
|
|
Дата добавления: 2014-12-26; Просмотров: 2965; Нарушение авторских прав?; Мы поможем в написании вашей работы!