
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Дихроматометрическое титрование
|
|
|
|
Кривые окислительно-восстановительного титрования
Кривые окислительно восстановительного титрования строят в следующих координатах. По оси y откладывают изменение окислительно-восстановительного потенциала, а по оси x объем прибавленного титранта или степень оттитрованности
f =
где n – количество оттитрованного в данный момент вещества, а n0 – исходное количество вещества. f – рассчитывается также как
где
V – объём титранта, прибавленного в данный момент, а V – объём титранта в точке эквивалентности.
Наибольшие изменения потенциала раствора наблюдаются в точке эквивалентности или около неё, так как именно в этой области происходит самое большое изменение отношения концентраций окисленной и восстановленной форм редокс-пар. На кривых титрования обнаруживается скачок потенциала. Расчётные теоретические кривые титрования строят для того, чтобы определить интервалы скачка с целью подбора соответствующего индикатора. Потенциал перехода между редокс-формами индикатора должен попасть внутрь скачка на кривой титрования.
Если в окислительно-восстановительной реакции не участвуют протоны или реакция проводится при строго определённой концентрации Н+ ионов, то расчёт потенциала в точке ковалентности проводят по формуле
где Е и Е - стандартные потенциалы двух редокс-пар,
а n1 n2 – число электронов, принимаемых или отдаваемых в реакции, соответственно.
Если при титровании не используются редокс-индикаторы, как, например, в перманганатометрии, то построение кривых титрования не имеет практического смысла.
Дихроматометрией называется метод определения веществ, основанный на реакции их окисления дихромат-ионом. Стандартный потенциал редокс-пары
равен 1,33 В, имеет достаточно высокое значение, поэтому дихромат-ион способен окислить целый ряд веществ. Реальный потенциал редокс-пары возрастает с повышением концентрации ионов водорода в соответствии с уравнением Нернста, то есть с понижением рН среды окислительная способность дихромат-ионов увеличивается. Титрантом метода является водный раствор дихромата калия, чаще всего с эквивалентной концентрацией 0,1 моль/л.
Рабочий раствор дихромата калия можно приготовить по точной навеске. Дихромат калия удовлетворяет всем требованиям первичного стандарта, при хранении в закрытой ёмкости в тёмном месте расвор дихромата калия стабилен и не изменяет свой титр в течение длительного времени. Эквивалентное число в реакции окисления в кислотной среде z = 6. Эквивалентная масса М = Э = 49,031 г/моль
Приведём формулу расчёта кривых титрования железа (II) дихроматом калия. При титровании протекает реакция
До точки эквивалентности в растворе присутствуют как исходные ионы, так и ионы, образовавшиеся в ходе реакции
Уравнения Нернста для двух редокс-пар следующие
Расчёт потенциала до точки эквивалентности ведут по уравнению
(1)
(2)
В точке эквивалентности Е = Е1 = Е2
Проводя определённые алгебраические преобразования, получаем формулу:
Расчёт после точки эквивалентности ведут по уравнению (2).
По приведённым формулам строят кривую титрования железа (II) дихроматом калия (рис. 1).
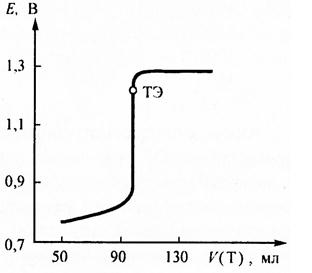
Рис. Рассчитанная кривая ОВ титрования 100 мл кислого 0,05 моль/л раствора железа (II) раствором дихромата калия с молярной концентрацией эквивалента 0,05 иоль/л. Исходная концентрация ионов водорода [H+] = 1 моль/л. ТЭ – точка эквивалентности.
Полученная кривая несимметрична относительно точки эквивалентности. Скачок на кривой титрования лежит в пределах от 0,95 до 1,3 В. Потенциал в точке эквивалентности равен 1, 223 В. Следовательно в качестве индикатора можно применять n-фенилантраниловую кислоту (Е = 1 В), ферроин (Е = 1,06 В), но нельзя использовать дифениламин, потенциал которого равняется 0,76 В и лежит за пределами скачка. Без индикаторов дихромат калия также не применяется, поскольку имеет недостаточно интенсивную окраску, непригодную для точной визуальной фиксации точки эквивалентности.
В аналитической практике титрование раствора Fe(II) раствором дихромата калия проводят в присутствии ортофосфорной кислоты для связывания образующегося железа (III) в прочный бесцветный фосфатный комплекс. В результате равновесие смещается в сторону образования Fe3+ и скачок на кривой титрования расширяется в сторону более низкого потенциала и лежит в пределах от –0,68 В и до –1, 3 В. Следовательно в присутствии фосфорной кислоты ТВ можно применять в качестве индикатора также дифениламин.
|
|
|
|
|
Дата добавления: 2014-12-26; Просмотров: 3990; Нарушение авторских прав?; Мы поможем в написании вашей работы!