
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 6. Введение в количественный анализ
|
|
|
|
Различные аналитические классификации катионов по группам
Статья VII. Введение
Статья VI.
Основной задачей качественного химического анализа катионов (да и анионов) является идентификация (открытие) того или иного иона, т.е. доказательство его присутствия или отсутствия в анализируемом объекте.
Наилучшим образом эта задача была бы решена, если бы для каждого иона имелась характерная (специфичная) реакция, позволяющая открыть его в присутствии других ионов, т.е. использовать дробный метод анализа. Однако таких реакций известно не так уж много. Обычно несколько ионов, а не один взаимодействуют с аналитическим реагентом, давая различные продукты реакций, которые мешают однозначной идентификации каждого иона в отдельности (дают аналогичный эффект или маскируют нужный эффект).
Поэтому широкое распространение в аналитической химии получили групповые реагенты, которые используются при систематическом анализе катионов и анионов, требующем последовательного разделения и последующего открытия каждого из ионов. Групповой реагент дает сходные реакции с целой группой ионов. Так, например, хлорид-ионы С1 осаждают из водных растворов, содержащих катионы серебра Ag+ ртути (1) Hg22+, свинца Рb2+, смесь осадков их хлоридов — AgCl, Hg2Cl2 и PbCl2. Таким образом с помощью реакций с хлорид-ионами можно удалить из водного раствора целую группу катионов (причем, катионы свинца удаляются из раствора не полностью, так как хлорид свинца заметно растворим в воде).
В анализе анионов, для сравнения сульфат-ионы SO42- осаждают из растворов группу катионов — кальция Са2+ стронция Sr2+, бария Ва2+, свинца Рb2+ в виде смеси малорастворимых в воде сульфатов CaSO4, SrSO4, BaSO4 и PbS04.
Аналогично катионы серебра Ag+ осаждают из растворов группу анионов Сl-, Вr-, I-, CN-, SCN-, BrO3-, S2- в виде осадков соответствующих малорастворимых солей серебра — AgCl, AgBr, Agl, AgCN, AgSCN, AgBrО3, Ag2S.
Применяются и другие групповые реагенты.
При систематическом анализе катионов вначале с использованием групповых реагентов из смеси выделяют группы катионов, после чего внутри каждой группы с помощью тех или иных реакций разделяют и открывают индивидуальные катионы.
В связи с применением различных групповых реагентов сформировались и различные аналитические классификации катионов по группам или различные химические методы качественного анализа катионов: сероводородный (сульфидный), аммиачно-фосфатный, кислотно-основной, карбонатный, бифталатный, сульфидно-основной, тиоацетамидный. Наиболее распространенными являются три аналитические классификации катионов по группам: сероводородная (сульфидная), аммиачно-фосфатная (или фосфатно-аммиачная) и кислотно-основная, причем сероводородный метод анализа в последние десятилетия применяется все реже, так как он требует получения и применения токсичного сероводорода и довольно продолжителен.
Поэтому и разработаны «бессероводородные» методы качественного полумикроанализа, в которых сероводород не применяется — аммиачно-фосфатный, кислотно-основной и некоторые другие.
Следует отметить, что полный ход систематического анализа катионов по любой классификации в фармацевтическом и экологическом анализе практически никогда не используется [2], а сочетается с дробным анализом (где это возможно).
Аналитическая классификация катионов по группам базируется на химических свойствах катионов и тесно связана с их электронным строением и положением соответствующих элементов в периодической системе. Эта связь достаточно глубока и на первый взгляд не всегда проявляется в виде простой внешней корреляции. Например, как уже отмечалось выше, в качестве группового реагента на катионы Ag+, Hg22+, Pb2+ выступают хлорид-ионы Сl, хотя серебро, ртуть и свинец относятся к различным группам периодической системы химических элементов.
Кроме того, в анализе возникают сложности, т.к. с одной стороны, некоторые химические элементы могут образовывать несколько различных катионов. Например, железо образует катионы Fе2+ и Fе3+, ртуть — катионы Hg+ и Hg22+, медь — катионы Сu+ Сu2+ и т. д.
С другой стороны, один и тот же химический элемент может давать и катионы, и анионы. Так, марганец образует катион Мn2+ и анион МnО4-, хром — катион Сr3+ и анионы СrО42-, Сr2072- и т.д.
Поэтому невозможно так оптимально объединить все катионы по группам, чтобы в одну и ту же аналитическую группу входили только катионы элементов какой-то одной группы (или подгруппы) периодической системы, хотя в некоторых частных случаях это иногда удается. Например, катионы металлов Са2+, Sr2+ , Ba2+ — расположенных во второй группе периодической системы элементов, образуют и одну аналитическую группу, но катион магния Mg2+ в эту аналитическую группу не входит.
В основу той или иной аналитической классификации катионов по группам положены их сходство или различие по отношению к действию определенных аналитических реагентов и свойства образующихся продуктов аналитических реакций (растворимость в воде, в кислотах и щелочах, в растворах некоторых реагентов, способность к комплексообразованию, окислительно-восстановительные свойства), выделяющихся в виде газов, выпадающих в осадок, растворяющихся или дающих окраску.
Применение групповых реагентов на практике позволяет подразделять многие катионы по аналитическим группам. Однако не существует такая универсальная аналитическая классификация катионов, которая охватывала бы все известные катионы или, по крайней мере, катионы всех металлов.
Далее в таблицах представлены многие катионы в соответствии с наиболее распространенными сероводородной, аммиачно-фосфатной и кислотно-основной классификациями. В этих таблицах, правда, перечислены не все катионы, входящие в те или иные группы, а только те из них, которые наиболее часто встречаются в фармацевтическом анализе и эко-аналитическом контроле.
Заметим еще, что в водных растворах «голые» индивидуальные катионы металлов, особенно многозарядные, не существуют, поскольку они термодинамически неустойчивы и, реагируя с окружающими их молекулами воды или другими частицами, образуют комплексы (сольваты) различного состава. Поэтому используемая в дальнейшем форма написания катионов металлов с указанием числового значения их положительного заряда, например, Hg+, Bi3+ Sn4+ и т.д., условна и означает лишь то, что речь идет о соединении металла в соответствующей степени окисления, а не о действительном существовании таких ионов с обычно указываемым целочисленным значением заряда катиона металла.
При этом далеко не всегда известно, в форме каких комплексов присутствуют те или иные катионы в водном растворе. Обычно в растворах устанавливаются равновесия между различными химическими формами катиона металла, причем в зависимости от условий (соотношение концентраций реагентов, рН среды, температура, присутствие других веществ и т.д.) может доминировать (иметь максимальную концентрацию) та или иная форма.
Именно с учетом этого замечания мы и будем в дальнейшем для простоты пользоваться общепринятыми упрощенными символикой и терминологией при описании ионов, несмотря на их условность.
| Раздел 7.01 Сероводородная (сульфидная) классификация катионов | ||
| Группа | Катионы | Групповой реагент |
| I | Li+, Na+, K+, NH4+, Mg2+ | Нет |
| II | Са2+, Sr2+, Ва2+ | Раствор (NН4)СО3 в аммиачном буфере (рН = 9,2) |
| Ш | Al3+, Cr3+, * Zn2+, Mn2+, Fe2+, Fe3+, Co2+, Ni2+ ** | Раствор (NH4)2S (рН = 7—9) |
| IV | Cu2+, Cd2+, Hg2+, Bi3+, *** Sn2+, Sn4+, Sb3+, Sb5+, As3+, As5+ **** | Раствор H2S при рН = 0,5 (НС1) |
| V | Ag+, Hg22+. Pb2+ | Раствор НС1 |
| * Осаждаются в виде гидроксидов. ** Осаждаются в виде сульфидов. *** Сульфиды этих катионов не растворяются в растворе сульфида натрия Na2S и в растворе полисульфида аммония (NH4)2Sn. **** Сульфиды этих катионов растворяются в растворе сульфида натрия или полисульфида аммония. |
| Раздел 7.02 Аммиачно-фосфатная классификация катионов | |||||
| Группа | Катионы | Групповой реагент | |||
| I | Na+, K+, NH4+, | Нет | |||
| II | Li+, Mg2+, Са2+, Sr2+, Ва2+, Mn2+, Fe2+, * Fe3+, Al3+, Bi3+, Cr3+ ** | Раствор (NН4)2НРО4 в водном аммиаке (25%) | |||
| Ш | Cu2+, Zn2+, Cd2+, Hg2+, Co2+, Ni2+ | Раствор (NН4)2НРО4; фосфаты растворимы в водном аммиаке *** | |||
| IV | Sn2+, Sn4+, Sb3+, Sb5+, As3+, As5+ | Раствор H2S при рН = 0,5 (НС1) | |||
| V | Ag+, Hg22+, Pb2+ | Раствор НС1 | |||
| * Фосфаты этих катионов растворимы в уксусной кислоте СН3СООН ** Фосфаты этих катионов не растворимы в уксусной кислоте. *** Иногда групповым реагентом считают водный раствор аммиака, осаждающий гидроксиды этих катионов, растворимые в избытке аммиака | |||||
| Кислотно-основная классификация катионов | |||||
| Группа | Катионы (эффект) | Групповой реагент (эффект) | |||
| I | Li+, Na+, K+, NH4+ | Нет (прозрачный р-р) | |||
| II | Ag+, Hg22+. Pb2+ | Растворы НС1 (белый осадок) | |||
| Ш | Са2+, Sr2+, Ва2+ | Растворы Н2S04 (белый осадок) | |||
| IV | Zn2+, Al3+, Cr3+ (серо-зеленый), Sn2+, Sn4+, As3+, As5+ | Раствор NaOH (белый осадок) в присутствии Н2О2 (прозрачно) | |||
| V | Mg2+, Sb3+, Sb5+, Bi3+, Mn2+, Fe2+, Fe3+ (красно-бурый осад.) | Раствор NaOH или раствор аммиака, 25% (белые осадки) | |||
| VI | Cu2+ (синий), Co2+ (желтый), Ni2+ (фиолет.) Cd2+ и Hg2+ (б/ц) | Раствор аммиака, 25% (окрашенные растворы) | |||
Кислотно-основная классификация катионов по группам
Данная классификация катионов по группам основана на использовании в качестве групповых реагентов водных растворов кислот и оснований — хлороводородной кислоты НС1, серной кислоты H2SО4, гидроксидов натрия NaOH или калия КОН (в присутствии пероксида водорода Н2О2) и аммиака NН3. Хотя эта классификация менее совершенна, чем сероводородная, однако используется чаще, т.к. при ее использовании не требуется получение и применение токсичного сероводорода.
В соответствии с кислотно-основной классификацией систематический ход качественного анализа смеси катионов может быть представлен следующей схемой (рис. 4.1) [3]. 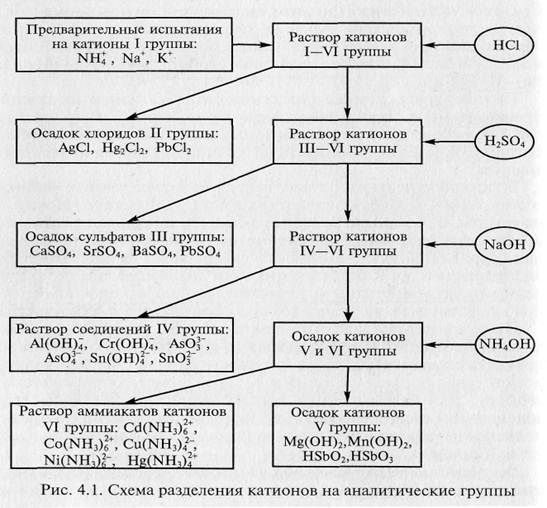
В результате получается шесть фракций раствора, содержащих катионы только своей аналитической группы. После этого на последующих стадиях анализа каждый катион может быть обнаружен «внутри» группы с помощью характерных (уже не обязательно специфичных) реакций.
Полная схема систематического анализа катионов по этой классификации (как и по любой другой) практически никогда не применяется при контроле ОС, качества лекарств и минерального сырья, однако отдельные элементы ее все же иногда используются в анализе.
Катионы, открываемые в рамках кислотно-основной классификации, подразделяют на шесть аналитических групп.
К первой аналитической группе относят катионы лития Li+, натрия Na+, калия К + и аммония NH4+ (иногда катион лития не включают в эту группу из-за его слабой растворимости). Групповой реагент отсутствует.
Ко второй группе относят катионы серебра Ag+, ртути (1) Hg22+ и свинца Рb2+. Групповым реагентом на катионы второй аналитической группы является водный раствор хлороводородной кислоты (обычно с концентрацией 2 моль/л НС1); реже — растворы растворимых хлоридов. Групповой реагент осаждает из водных растворов катионы второй аналитической группы в виде осадков малорастворимых в воде хлоридов серебра AgCl, ртути (1) Hg2Cl2 и свинца PbCl2;. Произведения растворимости этих трех хлоридов при комнатной температуре равны соответственно 1,78·10-10, 1,3·10-18 и 1,6 10-5. Как видно из этих данных, произведение растворимости хлорида свинца не очень мало, т.е. хлорид свинца заметно растворим в воде, особенно — при нагревании. Растворимость хлорида свинца в воде составляет (г/100 г воды): 0,99 при 25 °С и 2,62 при 80 °С. При действии группового реагента катионы свинца осаждаются из водного раствора не полностью — частично они остаются в растворе.
К третьей группе относят катионы кальция Са2+ стронция Sr2+ и бария Ва2+ Иногда к этой же группе относят и катионы свинца Рb2+ Групповым реагентом на катионы третьей группы является водный раствор серной кислоты (обычно с концентрацией 1 моль/л H2S04); реже - растворы водорастворимых сульфатов. При действии группового реагента катионы третьей аналитической группы осаждаются в виде малорастворимых в воде сульфатов кальция CaSО4, стронция SrSО4 и бария BaSО4 (свинец осаждается в виде сульфата PbSО4). Числовые значения произведений растворимости этих сульфатов при комнатной температуре равны: Кsо(CaSО4) = 2,5 10-5, для SrSО4 = 3,2 10-7, для BaSO4 = 1,1·10-10, для PbSО4 = 1,6·10-18. Произведение растворимости сульфата кальция не слишком мало; при действии группового реагента катионы кальция не полностью осаждаются из водного раствора в форме осадка сульфата кальция - часть ионов Са2+ остается в растворе. Для более полного осаждения катионов кальция в форме CaSО4 при действии группового реагента к анализируемому раствору прибавляют этанол, в присутствии которого растворимость CaSО4 уменьшается.
Сульфаты кальция, стронция и бария практически нерастворимы в разбавленных кислотах и щелочах. Сульфат бария заметно растворяется в концентрированной серной кислоте с образованием кислой соли Сa(HS04)2. Сульфат кальция растворим в водном растворе сульфата аммония (NH4)2S04 с образованием комплекса (NH4)2[Ca(S04)2], сульфаты стронция и бария — вообще не растворяются.
Четвертая группа включает катионы алюминия Al3+, хрома Сг3+, цинка Zn2+, мышьяка As3+ и As5+, олова Sn2+ и Sn3+. Иногда сюда относят и катионы сурьмы (Ш) Sb3+ Групповым реагентом является водный раствор гидроксида натрия NaOH (или калия КОН) в присутствии пероксида водорода Н2О2 (обычно — избыток 2 моль/л раствора NaOH в присутствии Н202); иногда — без пероксида водорода. При действии группового реагента катионы четвертой аналитической группы осаждаются из водного раствора в виде амфотерных гидроксидов, растворимых в избытке щелочи с образованием гидроксо-комплексов, например:
Al3+ + 3ОН- → А1(ОН)3 ↓, А1(ОН)3 + 3ОН- → [А1(ОН)6 ]3-
Cr3+ + 3ОН- → Сr(ОН)3 ↓, Cr(OH)3 + 3ОН- → [Cr(OH)6 ]3-
Zn2+ + 2ОН- → Zn(OH)2 ↓, Zn(OH)2 + 2ОН- → [Zn(OH)4]2-
Sn2+ + 2ОH- → Sn(OH)2 ↓, Sn(OH)2 + 4ОH- → [Sn(OH)6 ]4-
B присутствии пероксида водорода катионы Cr3+, As3+ и Sn2+ окисляются соответственно до хромат-ионов СгО42-, арсенат-ионов AsO3- и гексагидроксостаннат(VI)-ионов [Sn(OH6)]2-.
Осадки гидроксидов катионов четвертой аналитической группы не растворяются в водном аммиаке, за исключением гидроксида цинка Zn(OH)2, который растворяется в водном растворе аммиака с образованием аммиачного комплекса [Zn(NH3)4]2+.
При рассмотрении катионов четвертой аналитической группы мышьяк (III) и мышьяк(V) считают катионами As3+ и As5+ условно, так как в водных средах соответствующие соединения присутствуют обычно не в форме указанных катионов, а в форме анионов — арсенит-ионов AsO33- или AsO22-, - анионов ортомышьяковистой Н3АsО3 или метамышьяковистой HasO2 кислот и арсенат-ионов AsO3- - анионов мышьяковой кислоты H3AsO4. В концентрированных растворах соляной кислоты существуют комплексные анионы [AsCl4]- и [AsCI6]-.
Даже если бы исходное вещество и содержало формально мышьяк в виде катионов, например, АsС13, As2O3, As2O5 и т.д., то в водной среде оно гидролизуется с дальнейшим образованием анионной формы мышьяка(III) или мышьяка(V):
AsCl3 + 3Н20 = H3AsO3 + 3НС1
Аs2O3 + 3Н2O = 2Н3АsО3 = 2HAsO2 + 2Н2O
As2O5 + 3Н2О = 2H3AsO4 и т.д.
В соответствии с изложенным при проведении анализа по кислотно-основному методу обычно используют аналитические реакции на арсенит- или арсенат-анионы, а не на катионы мышьяка(III) или мышьяка(V).
К пятой аналитической группе относятся катионы магния Mg2+ марганца Мn2+, железа Fe2+ и Fe3+, сурьмы Sb3+ и Sb5+, висмута(III) Вi3+. Групповым реагентом является водный раствор щелочи (обычно 2 моль/л раствор NaOH) или 25%-й водный раствор аммиака. При действии группового реагента катионы пятой аналитической группы осаждаются из данного раствора в виде гидроксидов Mg(OH)2, Mn(OH)2, Fе(ОН)2, Fе(ОН)3, Sb(ОН)3, SbО(ОН)3, Вi(ОН)3. Гидроксиды катионов пятой аналитической группы не растворяются в избытке группового реагента, в отличие от катионов четвертой аналитической группы.
На воздухе гидроксиды марганца(II) и железа(III) постепенно окисляются кислородом:
4 Fе(ОН)2 + О2 + 2Н2О→ 4 Fе(ОН)3
2 Mn(OH)2 + О2 → 2 МnО(ОН)2
При действии группового реагента в присутствии пероксида водорода происходит окисление железа(II) до железа(III), марганца(II) – до марганца(IV), сурьмы(III) – до сурьмы(V):
2 Fe(OH)2 +H2O2 → 2 Fе(ОН)3
Mn(OH)2 + H2O2 → МnО(ОН)2 + Н2О
Sb(OH)2 + H2O2 → SbO(OH)2 + Н2О
К шестой аналитической группе относятся катионы меди(II) Сu2+, кадмия Cd2+, ртути(II) Hg2+, кобальта(II) Со2+ и никеля(II) Ni2+. Групповым реагентом является 25%-й водный раствор аммиака. При действии группового реагента на водные растворы, содержащие катионы шестой аналитической группы, вначале выделяются осадки различного состава, которые затем растворяются в избытке группового реагента (осадки соединений кобальта и ртути растворяются в избытке водного аммиака только в присутствии катионов аммония NH4+).
Катионы Cu2+, Co2+ и Ni2+ осаждаются из растворов их хлоридов в виде основных хлоридов CuOHCl, CoOHCl и NiOHCl, катионы кадмия — в форме гидроксида Cd(OH)2. При действии группового реагента на водные растворы хлорида ртути(II) HgCl2 или нитрата ртути(II) Hg(NO3)2 выделяются соответственно осадки HgNH2Cl и [Ohg2NH2]NO3.
Осадки основных солей меди(II), никеля(II) и гидроксида кадмия растворяются в избытке группового реагента с образованием соответствующих аммиачных комплексов:
CuOHCl + 4 NH3 → [Сu(NН3)4]2+ + ОН- + Сl-
NiОНСl+6 NН3 → [Ni(NН3)6]2+ +ОН- +С1-
Cd(OH)2 +4 NH3 → [Cd(NH3)4] 2+ +2 OH-
Осадки, выпавшие из растворов солей кобальта(II) и ртути(II) при действии группового реагента, растворяются в избытке аммиака в присутствии солей аммония с образованием аммиачных комплексов:
CoOHCl+5 NH3 + NH4+ → [Со(NH3)6]2+ +Сl +Н2O
HgNH2Cl + 2 NH3 + NH4+ → [Hg(NH3)4]2++ Cl-
[OHg2NH2]NO3 +4 NН3 +3 NH4+ → 2 [Hg(NH3)4]2+ + NO3- +H20
Аммиачный комплекс кобальта(II) грязно-желтого цвета окисляется на воздухе до аммиачного комплекса кобальта(III) вишнево-красного цвета.
Контрольные вопросы и задания
1. Какие бывают аналитические классификации катионов и на чем они основаны?
2. Охарактеризуйте подробнее кислотно-основную классификацию катионов (нарисуйте схему разделения на группы).
3. Дайте подробную характеристику какой-нибудь одной группы катионов и напишите их реакции с групповыми реагентами.
4. Перечислите характерные реакции катионов одной из групп и напишите их уравнения для одного из них.
(Воспользуйтесь для этого электронными текстами: «Качественный анализ S- P- и D-катионов»)
Рекомендуемая литература:
1. Харитонов Ю.Я. Аналитическая химия (аналитика). Кн. 1. Общие теоретические основы. Качественный анализ. Учеб. для вузов. – М.: Высш. шк., 2001. – с. 288-291, 320-324.
2. Бессероводородные методы качественного полумикроанализа. /Под ред. А.П. Корешкова. – М.: Высш. школа, 1979.
3. Голубков Ю.М., Головачева В.А., Ефимова Ю.А. и др. Аналитическая химия. Учебник. /Под ред. А.А. Ищенко. – М.: Издательский центр «Академия», 2004. – с. 80.
|
|
|
|
|
Дата добавления: 2014-12-26; Просмотров: 1578; Нарушение авторских прав?; Мы поможем в написании вашей работы!