
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства. Общая характеристика
|
|
|
|
Общая характеристика
Алкены
Химические свойства алкенов (олефинов или этиленовых углеводородов) определяет двойная углерод-углеродная связь. Углерод находится во II валентном состоянии sр2 -гибридизация.
Рассмотрим основные характеристики двойной связи:
| Связь | Длина, нм | Энергия, кДж/моль | Полярность, Кл • м | Поляризуемость, см3 • моль |
| C=С | 0,134 | 612,3 | 4,17 | |
| С–С | 0,154 | 346,9 | 1,29 |
Анализ таблицы показывает, что;
1. σ-связь более прочная, чем π-связь.
2. π-электроны более чувствительны к влиянию внешнего электрического поля чем σ-связь. В присутствии заряженной частицы электронное облако π-связи легко смещается в сторону положительного заряда.

Следовательно: в определенных условиях π-связь может разрываться гетеролитически (по ионному механизму).
Алкены вступают в реакции:
1. Присоединение по π-связи, наименее прочной и более реакционноспособной. Образующие ее π-электроны более доступны для реагента, чем электроны σ-связи.
2. Имеются реакции замещения (S) в аллильное положение.

Реакции присоединения (А)
Гидрирование. Следует подчеркнуть, что гидрирование алкенов протекает только в присутствии катализатора. Без катализатора водород Н2 или [H] в момент выделения не присоединяется к алкенам.

Галогенирование. К алкенам легко присоединяется галоген:

Легче идет присоединение Сl2, труднее J2. Следует подчеркнуть, что в зависимости от условий реакция может идти по радикальному или ионному механизмам.
Механизм радикального присоединения
Под действием света, при нагревании или в присутствии других радикалов реакция присоединения протекает по радикальному (гомолити-ческому) механизму.
Первая стадия – инициирование:

Вторая стадия – рост цепи:

Реакция (1) – основная, идет через образование стабильного вторичного радикала.
Третья стадия – обрыв цепи:

Механизм ионного присоединения
 Галоген и олефин в темноте не взаимодействуют, но если взять влажные продукты, то реакция идет даже в темноте. Н2О вызывает поляризацию галогена, при этом ка-
Галоген и олефин в темноте не взаимодействуют, но если взять влажные продукты, то реакция идет даже в темноте. Н2О вызывает поляризацию галогена, при этом ка-
тион Br+ является более активной частицей.
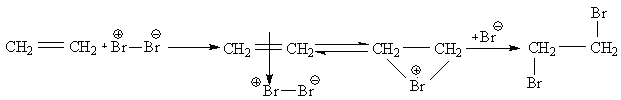 π-комплекс бромониевый ион
π-комплекс бромониевый ион
Получаются только трансизомеры, т.к. анион Br– не может присоединиться к той стороне где уже имеется Br.
Гидрогалогенирование. Галогеноводороды легко присоединяются к олефинам. В зависимости от условий реакция может протекать по ионному или радикальному механизмам. При взаимодействии жидких веществ в присутствии кислоты или основания в растворе воды или какого – либо полярного растворителя наиболее вероятным является ионный механизм реакции.
Механизм ионного (электрофильного) присоединения
Рассмотрим взаимодействие пропилена (несимметричного олефина) с бромводородом. НBr диссоциирует в воде с образованием протона, который и взаимодействует с электронами p-связи пропилена:

Предпочтительнее протекание реакции (2), с образованием более устойчивого вторичного карбкатиона, который затем взаимодействует с анионом Br -.

В результате образуется вторичный алкилгалогенид.
Такая специфичность присоединения к несимметричным алкенам известна под названием правила Марковникова – реакция присоединения к атому углерода в олефине протекает с образованием наиболее устойчивого промежуточного карбкатиона.
Правило Марковникова соблюдается только при ионном (гетеролитическом) механизме присоединения.
Если реакцию инициирует свет, высокая температура или вещества, образующие при разложении свободные радикалы (H2O2, O2, R-O-O-R и др.) она протекает по радикальному механизму.
Механизм радикального присоединения
(перекисный эффект Караша)

Основное направление реакции – 1, т.к. образуется более стабильный вторичный радикал:
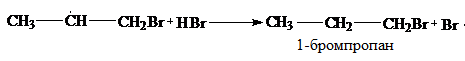
Первичный алкилгалогенид (1-бромпропан) является основным продуктом этой реакции, вторичный алкилгалогенид (2-бромпропан) и вторичный спирт (пропанол –2) – побочными.
|
|
|
|
|
Дата добавления: 2014-12-26; Просмотров: 530; Нарушение авторских прав?; Мы поможем в написании вашей работы!