
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Алициклические Ароматические
|
|
|
|
Предельные Непредельные Карбоциклические Гетероциклические
Ациклические Циклические
открытая углеродная цепь закрытая углеродная цепь
(алифатические, соед.жирного ряда
alifatik -жирный)
Алканы Алкены Алкины Цепь состоит В цепи могут
только из быть и др.
СnН2n+2 СnН2n СnН2n-2 атомов С гетероатомы
Атомы водорода могут быть заменены другими атомами или группами атомов, так называемыми функциональными группами. Химическая природа этих групп служит вторым классификационным признаком.
2. В зависимости от природы функциональных групп органические соединения подразделяют на классы.
Важнейшие классы органических соединений.
Классы соединений Функциональные группы
Название Общая формула Название Общая формула
Спирты R-OH гидроксил -OH
Оксосоединения:
Альдегиды 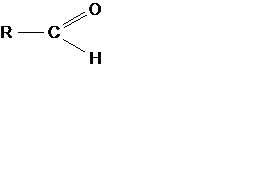 карбонил >C=O
карбонил >C=O
Кетоны 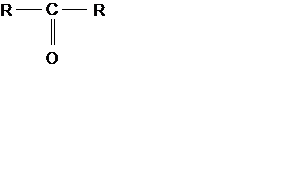
Карбоновые  карбоксил
карбоксил 
кислоты
Нитросоединения R-NO2 нитрогруппа -NO2
Аминосоединения R-NH2 аминогруппа -NH2
R-NH-R

Сульфосоединения: сульфогруппа -SO3H
Сульфокислоты R -SO3H
Галогенопроизводные R-X галогены -F,-Cl,-Br,-I
Эфиры:
Простые R-O-R эфирная группа 
Сложные  сложноэфирная
сложноэфирная 
группировка
Где R– углеводородный радикал.
Углеводородный радикал это та часть молекулы, которая остается если углеводород лишается одного или нескольких атомов водорода.
Например:
Метан СH4; метил СН3 –; метилен СН2 <; метин 
Этан С2Н6; этил С2Н5 –; этилиден СН3-СН<; этилидин 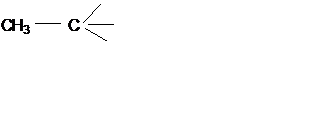
Различают радикалы первичные, вторичные, третичные, четвертичные. Если у радикала свободная валентность находится у первичного атома углерода радикал называется первичным, у вторичного - вторичным и т.д.
Первичным называют тот атом углерода, который связан только с одним другим атомом углерода, вторичным - углерод, связанный с двумя другими атомами углерода, третичным - с тремя и т. д.
* *** ** *
Hапример: CH3 —CH — СН 2 — СН3 * - первичный атом
ï
*СН3 **- вторичный
*** - третичный
Названия наиболее часто встречающихся радикалов:
Винил СН2 = СН- фенил С6Н 5 -
Аллил СН2 = СН - CH- фенилен С6Н 4<
Ацетиленил СH  C- бензил С6Н 5 –CH2-
C- бензил С6Н 5 –CH2-
Метокси СН3-О- бензилиден С6Н 5 – CH<
Ацетил СH3-С = О бензоил С6Н 5 – C = O
ï ï
 1.2. Номенклатура
1.2. Номенклатура
Для названия углеводородов используются номенклатурами:
· Тривиальной
· Рациональной
· Систематической
Рассмотрим более подробно систематическую или женевскую номенклатуру, т.к. все последующие номенклатуры (льежская. ИЮПАК и др.) используют ее основные положения.

Чтобы назвать соединение надо:
1) Выбрать самую длинную углеродную цепь, радикалы у крайних атомов углерода стоять не должны.
2) Провести нумерацию с того конца цепи ближе к которому стоит радикал. Если несколько радикалов – нумерацию определяет самый маленький. При равном расположении радикалов нумерация проводится с того конца где больше разветвление. Порядок старшинства
I, П, Ш, 1У, У, У1.
3) Построение названия. Нефункциональные заместители, азотсодержащие функциональные группы, углеводородные радикалы называются перед главной цепью. Цифра, обозначающая место, ставится перед обозначением заместителя.
Кратные связи, функциональные группы, содержащие кислород и их сернистые аналоги, обозначаются с соответствующими окончаниями после главной цепи. Цифра, показывающая место, ставится после данного окончания.
Примеры:
Начало нумерации определяет ближайший к краю радикал
 5- метил- 3- этилоктан
5- метил- 3- этилоктан
Начало нумерации определяет старший радикал
 3-метил-6-этилоктан
3-метил-6-этилоктан
Начало нумерации определяет карбоксильная группа
 4-метилгексен-2-овая кислота
4-метилгексен-2-овая кислота
1.3. Электронное строение σ- и π- связей Три типа гибридизации атомов углерода
Развитие современных теоретических воззрений в области органической химии связано с квантово-механическим подходом к изучению строения соединений и реакций. Квантово-механический подход к электронному строению и поведению атомов и молекул выражается уравнением Э. Шрёдингера (1926), связывающим энергию электрона с волновым движением. Из квантовой механики известно, что электроны в атоме располагаются на определенных орбиталях, которые отличаются разным запасом энергии. Положение электрона на орбитали не может быть определено точно, а характеризуется вероятностью (ψ2) пребывания электрона в определенной точке пространства. Функция ψ названа орбиталью. Различают атомные орбитали (АО) имолекулярные орбитали (МО), на которых находятся электроны в молекуле.
При изучении органической химии особый интерес представляет электронное строение атома углерода, так как с этим связаны его особые свойства, определяющие во многом различия между органическими и неорганическими соединениями.
Углерод - первый элемент IV группы периодической системы элементов. В основном (невозбужденном) состоянии электронная конфигурация атома углерода 1s2 2s2 2p2. В момент химической реакции атом углерода переходит из основного в возбужденное состояние, происходит распаривание 2s-электронов и переход одного их них на свободную 2p- орбиталь. Образуются 4 неспаренных электрона: один – 2s и три – 2p, различные по своему энергетическому состоянию.Электронная конфигурация возбужденного атома углерода – 1s22s 2p3.
Согласно квантово-механическим представлениям электроны s- уровня располагаются на орбиталях сферической формы, а электроны p-уровня на 3-х гантелеобразных орбиталях, направленных по трем взаимно перпендикулярным осям координат. Можно ожидать, что связи, образованные углеродом с другими атомами будут неравноценными. В действительности, в симметрично построенных органических соединениях (например СH4, CCl4 и др.) все 4 связи одинаковы. Для объяснения равноценности связей Полингом введено понятие гибридизации (смешения) орбиталей, согласно которому электроны в молекулах, как правило, располагаются не на «чистых» s- и p- орбиталях, а на смешанных – гибридных. Такие орбитали полнее перекрываются с орбиталями других атомов, образуя более прочные связи.
Для атома углерода возможны три валентных состояния с различными типами гибридизации.
1 валентное состояние –sp3 гибридизация
Смешение одной 2s- и трех 2p- –орбиталей приводит к образованию четырех одинаковых гибридных орбиталей и атом углерода можно представить следующей схемой:

Такая геометрия обеспечивает минимальное отталкивание между электронами. Ниже приведены простейшие схемы перекрывания орбиталей и образование σ – связей:

Первое валентное состояние характерно для предельных углеводородов.
2 валентное состояние –sp2 гибридизация
Образуется в результате смешения одной s и двух 2p орбиталей (рис.а), третья 2p орбиталь не принимает участие в гибридизации и располагается в плоскости перпендикулярной плоскости гибридных орбиталей (рис. б, в).
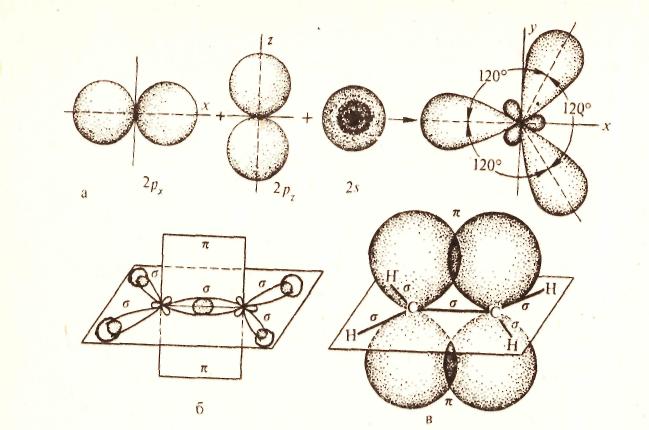
|
Этот тип связей характерен для непредельных углеводородов ряда этилена CH2=CH2.
3 валентное состояние –sp гибридизация
При смешение одной 2s и одной 2p орбиталей образуется две гибридные орбитали расположенные на одной прямой (рис.а). Две другие 2р орбитали не участвуют в гибридизации и располагаются во взаимно перпендикулярных плоскостях (рис.б).

Этот тип гибридизации характерен для атомов углерода, связанных тройной связью – непредельные ряда ацетилена HC≡CH.
|
|
|
|
|
Дата добавления: 2014-12-26; Просмотров: 1051; Нарушение авторских прав?; Мы поможем в написании вашей работы!