
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Типы химической связи
|
|
|
|
Ионная или электровалентная связь возникает между атомами, которые сильно отличаются по электроотрицательности (NaCl, KOH).
Электроотрицательность (по Полингу, 1932 г.) – способность атома в соединении притягивать к себе электроны.
Электрон от одного атома передается другому, образуются два противоположно заряженных иона, которые электростатически притягиваются:

Отличительными чертами ионных соединений являются мгновенность протекания реакций, диссоциация и сольватация ионов в водных растворах, высокие температуры плавления и кипения, растворимость в полярных растворителях, электрическая проводимость растворов и расплавов. Связь характеризуется значительной полярностью.
В органической химии в основном мы встречаемся с ковалентной связью.
Ковалентная связь образуется в результате обобщения неспаренных электронов с противоположными (антипараллельными) спинами.
Схематично это можно изобразить следующим образом:
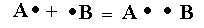
При этом происходит перекрывание орбитали одного атома с орбиталью другого. Например, образование ковалентной связи в атоме водорода можно представить следующей схемой:

Связь между атомами, осуществляемая одной парой электронов называют простой, одинарной или сигма (σ) - связью. Если в образовании ковалентной связи принимают участие две или три электронные пары, то связь называют кратной, она может быть двойной (две пары электронов) или тройной (три пары электронов).
Основные характеристики ковалентной связи:
Длина связи - определяет расстояние между ядрами и зависит от характера связи, чем больше кратность связи, тем она короче. Измеряется в нанометрах (1нм= 10-9м).
Энергия связи - энергия, необходимая для разрыва данной связи; характеризует прочность связи, чем выше энергия, тем связь прочнее. Измеряется в кДж/моль.
|
|
|
Полярность (статическая характеристика) - определяется степенью смещения электронной плотности между атомами в молекуле, связана с электроотрицательностью атомов. Измеряется в кулонметрах (Кл • м).
Если атомы, образующие химическую связь, обладают одинаковой электроотрицательностью - связь неполярна и возникает симметричная молекулярная орбиталь. Например, у этана СН3 –СН3, водорода Н2, кислорода О2 и др. Если химической связью связаны атомы с различной электроотрицательностью, то в такой несимметричной молекуле электронная плотность смещена к более электроотрицательному атому. Так, например в молекуле хлорметана:

связь поляризована в силу различной электроотрицательности атомов С и Cl. Электронная плотность смещена к атому Cl и на нем возникает частичный отрицательный заряд –δ, а на атоме углерода – частичный положительный заряд + δ.
Смещение электронной плотности по s- связям в сторону более электроотрицательного атома называется индукционным эффектом или индукционной поляризацией (I).
Смещение электронной плотности происходит по всей углеродной цепочке и частичный положительный заряд возникает не только на соседнем атоме углерода. Так, например в хлорпропане:
H3C+δ3 →CH2+δ2→CH2+δ1→Cl-δ,
индукционный эффект затухает по цепочке атомов углерода и частичный положительный заряд + δ1 > + δ2 > + δ3.
Если смещение электронной плотности направлено по цепи в сторону заместителя (например, атома галогена), то такой эффект называют отрицательным (-I). В том случае, если атом смещает электронную плотность в сторону цепи (от себя), индукционный эффект считают положительным (+I). Например, в хлорпропане индукционный эффект атома хлора отрицательный -I, a C3H7- группы положительный +I. В количественном отношении индукционный эффект невелик.
|
|
|
Поляризуемость (динамическая характеристика) — характеризует способность изменять полярность под влиянием внешнего электрического поля.
π - связи поляризуются гораздо легче, чем σ - связи. Измеряется в см3моль.
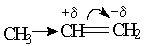
Частным случаем ковалентной связи является связь координационная или донорно-акцепторная. Она возникает, когда один из атомов или ионов, вступающих в химическую связь, имеет неподеленную электронную пару (донор), а другой - свободную незаполненную орбиталь (акцептор).
 Например, при взаимодействии кислоты с аммиаком возникает координационная связь:
Например, при взаимодействии кислоты с аммиаком возникает координационная связь:
NH3+H+=NH4+ или
Разновидностью координационной связи является семиполярная связь. Она осуществляется также за счет неподеленной пары электронов одного из атомов, но отдавая эту пару для образования связи атом - донор заряжается положительно, а акцептор - отрицательно. В результате новую связь можно рассматривать как одновременное проявление двух видов связи -ковалентной (обобществление электронной пары) и ионной(за счет взаимодействия противоположных зарядов). Например:

Водородная связь возникает между атомами, имеющими свободную электронную пару (кислород, азот, сера и др.) и водородом, который связан с другим атомом высокополярной ковалентной связью (например, О-δ —Н+δ).
Возникновение такой связи, например между молекулами воды, можно изобразить следующей схемой:

Водородная связь играет огромную роль в живой природе в биохимических процессах. Благодаря водородным связям фиксируются вторичные и третичные структуры белков, образуются связи в двойных спиралях ДНК.
1.5 Типы органических реакций
Все химические реакции сопровождаются разрывом одних химических связей и возникновением других. Распад ковалентной связи между двумя атомами может протекать с образованиемсвободных радикалов - гомолитический илиионов - гетеролитический распад.
Гомолитический или радикальный распад ковалентной связи можно представить следующей схемой:
А• | • В = А• +• В
Активный свет, кислород и другие радикалы способствуют гомолитическому распаду молекул. Свободные радикалы имеют неспаренный (холостой) электрон; они образуются, главным образом, в газовой фазе, т.е. при нагревании, и в растворах неполярных растворителей. Открыть их присутствие в реакционной системе можно с использованием методов электронной спектроскопии.
|
|
|
Гетеролитический или ионный распад связи схематически можно описать следующим образом:
А:) В ↔ А:−+В+
или А (: В ↔ А + +: В−
При разрыве связи одна их частей молекулы захватывает оба электрона ковалентной связи, образуются отрицательные карбанионы и карбкатионы. Ионный распад происходит в присутствии катализаторов А1С13,FеС13и др. кислот Льюиса, протекает в полярных растворителях, на холоде и в темноте.
По характеру химических превращений можно выделить три основных типа реакций.
Реакции замещения S (S - от англ. Substitution):
CH4+Cl2→CH3Cl+HCl
хлорметан
Реакции присоединения А (А - от англ. Addition - присоединение):
CH2=CH2+Br2→CH2Br-CH2Br
1,2-дибромэтан
К реакциям присоединения относят и реакции восстановления (присоединение атомов водорода): [ Н]

ацетон изопропиловый спирт
К этому типу реакций можно также отнести реакции полимеризации, когда в результате присоединения друг к другу большого числа простых веществ (мономеров) образуется новое вещество сложного строения с большей молекулярной массой:
n CH2=CH2 → [-CH2-CH2-]n
Сюда относят также реакции конденсации и поликонденсации, когда образуется более сложное вещество в результате соединения нескольких молекул и выделения простых веществ (воды, аммиака и др.):
HO-CH2-CH2-OH + HO-CH2-CH2-OH→HO-CH2-CH2-O-CH2-CH2-OH
этиленгликоль -H2O димер этиленгликоля
n HO-CH2-CH2-OH → [-CH2-CH2-O-]n + n H2O
Реакции отщепления (элиминирования) Е (Е-от англ. Elimination-исключение, устранение):
Н+,t
CH3-CH2-CH2OH → CH3 -CH=CH2 + H2O
Однако химические реакции удобнее классифицировать по механизмам.
1.6. Механизмы химических реакций
С электронной точки зрения под механизмом химической реакции понимают способ нарушения валентных связей в молекулах и последовательность состояний, через которые проходят реагирующие вещества до превращения в продукты реакций, т. е. подробную, схему реакции. Выяснение механизма реакции необходимо для выбора оптимальных технологических условий ведения процесса.
|
|
|
В зависимости от характера атакующего реагента и природы связей в реагирующей молекуле реакция может протекать по двум основным механизмам:
- гетеролитическому или ионному;
- гомолитическому или радикальному.
Рассмотрим более подробно классификацию химических реакций в зависимости от атакующей частицы.
Пример 1: Реакция - замещения S.
Реагент - электрофильный Е+
A++:B-+E+→ A++B:E
или A:-+B++E+→ A:E+B+
Электрофильный или элетроноакцепторный реагент Е+ для образования новой связи использует пару электронов, принадлежащую реагирующей молекуле.
Электрофилы или электроноакцепторы:
катионы – H+,Cl+,NO2+,SO3H+,R+,R-C+=O;
молекулы со свободными орбиталями – AlCl3, FeCl3, ZnCl3, BF3.
Реакции, идущие с участием таких реагентов, называются электрофильными. Это могут быть реакции замещения, присоединения и отщепления. Пример 2: Реакция - замещения S.
Реагент - нуклеофильныйNu:
A+ +:В- + Nu:- → A:Nu +:В-
или А:-+ В + + Nu:- → А:- + B:Nu
Нуклеофильный реагент для образования новой связи предоставляет электронную пару.
Нуклеофилы или электронодоноры:
анионы - НО -, RO -, Cl-, RCOO -, CN -, R-, NH2-;
молекулы, содержащие атомы с неподеленными электронными парами – H2O, C2H5O Н.
Реакции, идущие с участием этих реагентов, называются нуклеофильными. Это могут быть реакции замещения, присоединения и отщепления.
Пример 3: Реакция - замещения S.
Реагент - радикал Х•.
А • | • В + Х • → А••X + В•
или А •│• В + Х • → А• + В••Х
По радикальному механизму могут протекать реакции замещения, присоединения или отщепления. Однако, реакции присоединения и отщепления чаще всего протекают по ионному (гетеролитическому) механизму.
Устойчивость радикалов и ионов карбония
Место вступления реагента в молекулу углеводорода определяется вероятностью образования и стабильностью возникающего радикала или иона.
Изменение устойчивости радикалов при переходе от первичного радикала к третичному:
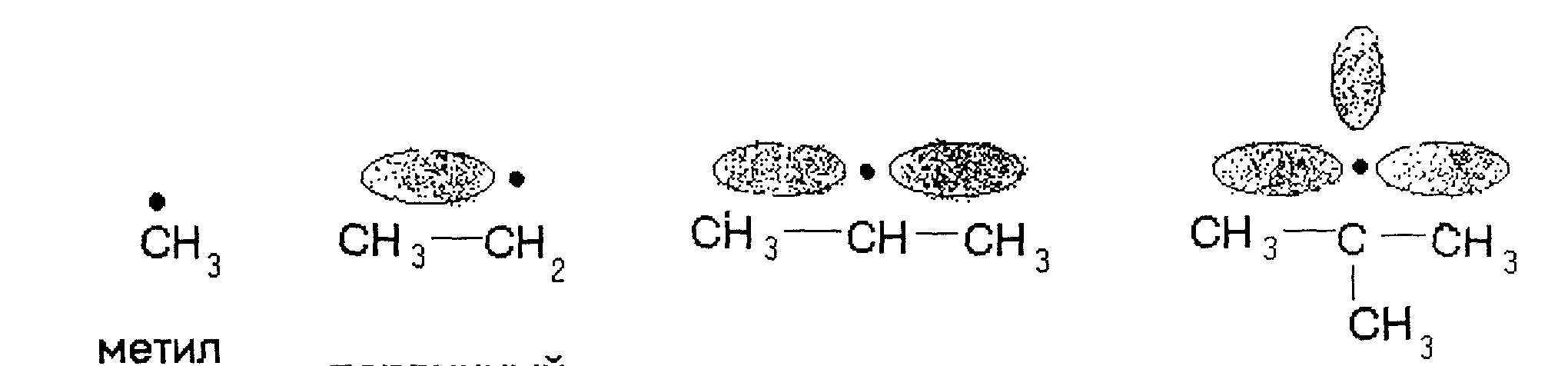
первичный вторичный третичный
рост стабильности радикалов
Третичные радикалы более стабильны, т.к. свободная орбиталь сопрягается с наибольшим числом электронов С -Н связей.
В связи с этим реакции замещения идут избирательно и наиболее легко у третичного атома углерода.
Стабильность ионов карбония также увеличивается в ряду:

|
|
|
|
|
Дата добавления: 2014-12-26; Просмотров: 1746; Нарушение авторских прав?; Мы поможем в написании вашей работы!