
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства. Стабильность третичного иона карбония выше, т.к
|
|
|
|
Алканы
Стабильность третичного иона карбония выше, т.к. частичный положительный заряд на атоме углерода нейтрализуется индукционным эффектом наибольшего числа радикалов.
Стабильность радикалов и ионов карбония заметно возрастает, если в распределении неспаренного электрона принимают участие π-орбитали, что приводит к делокализации неспаренного электрона или заряда:

Алканы или парафины – алифатические предельные углеводороды, имеющие незамкнутую, открытую цепь углеродных атомов (прямую или разветвленную). Атомы углерода в алканах находятся в состоянии sp3 -гибридизации и связаны между собой простой (одинарной) σ-связью.
Простейшим представителем и родоначальником гомолитического ряда предельных углеводородов является метан СН4, общая формула углеводородов – СnН2n+2. Изомеры углеводородов появляются, начиная с бутана (2 изомера); для С5Н12 – известны три изомера.
Основное свойство алканов чрезвычайно высокая химическая инертность что связано с высокой прочностью, малой полярностью и поляризуемостью σ-связи. Они не вступают ни в какие реакции при низкой температуре даже с самыми активными реагентами, например такими как Вг2, КМnО4, НNO3, О2, Н2SО4 конц, NаОН конц. и т.д.
Предельные углеводороды не вступают в реакции присоединения из-за полной насыщенности атомов углерода водородом. Для них характерны реакции замещения. При этом может произойти разрыв связей С - Н либо С - С. В алканах связи С - С и С - Н, обладая незначительной полярностью, при разрыве образуют главным образом не ионы, а радикалы, т.е. разрыв идет в основном по гомолитическому механизму. Предпочтительнее разрыв идет по связи С - Н, в связи с ее большей доступностью для атаки химическими веществами.
Важнейшие реакции предельных углеводородов - радикальные реакции (галогенирование, нитрование, сульфохлорирование, крекинг). Радикальные реакции имеют ряд определенных характеристик: на течение процесса не оказывают влияние полярность растворителя и обычные катализаторы; они существенно ускоряются в присутствии инициаторов, при облучении ультрафиолетовым светом или под действием γ – излучения и обычно протекают при нагревании. В присутствии ингибиторов (веществ, легко взаимодействующих со свободными радикалами с образованием устойчивых продуктов), например иода, гидрохинона, кислорода радикальная реакция замедляется или прекращается.
Энергия активации радикальных реакций обычно не велика (41,9 – 83,8 кДж/моль), а скорости реакций очень высоки, поэтому при наличии свободных радикалов характерны цепные реакции, в которых исходный радикал вызывает множество дальнейших стадий. Все радикальные реакции включают инициирование (зарождение цепи), рост цепи и заканчиваются обрывом цепи в результате взаимодействия свободных радикалов. Теория цепных реакций была создана советским ученым Н.Н.Семеновым и английским ученым Хиншельвудом, работавшими в тесном контакте (оба ученых удостоены Нобелевской премии).
Рассмотрим цепной радикальный механизм реакции галогенирования на примере реакции хлорирования метана.
I стадия – инициирование или зарождение цепи
Под действием активного света (hυ) атом хлора распадается на два свободных радикала: Cl •|•Cl –hυ → 2Cl•
II стадия – рост цепи (развитие цепи):
СH4 + Cl• → CH3• + HCl
•CH3+Cl2 → CH3Cl+Cl• и т.д.
Ш стадия – обрыв цепи.
Обрыв цепи реакции наступает при соединении радикалов или атомов в молекулы: 2Cl• → Cl2; 2CH3• → C2H6 и т.д.
Хлорирование метана протекает бурно и обычно ведет к образованию смеси моно - и полигалогенидов.
При хлорировании гомологов метана замещение водорода происходит легче всего при третичном углеродном атоме, труднее - при вторичном и ещё труднее - при первичном. Это объясняется тем, что первичные, вторичные и третичные радикалы имеют различную устойчивость (см. выше).
Так, хлорирование пропана протекает избирательно - атомы водорода, связанные с вторичными углеродными атомами, замещаются легче, чем связанные с первичными.
I стадия - инициирование или зарождение цепи:
hυ
С1 • | • С1→ 2С1 •
II стадия - рост цепи (развитие цепи):
CH3-CH• + HCl (1)
CH3-CH2-CH3 + Cl • CH3
CH3-CH2-CH2 • + HCl (2)
Предпочтительно образование радикала (1) - вторичного, обладающего наибольшей стабильностью.
CH3-CH• + Cl•|•Cl → CH3-CH-CH3 + Cl•
│ │
CH3 Cl
Ш стадия - обрыв цепи:
CH3-CH• + •CH-CH3 → CH3-CH-CH-CH3
│ │ │ │
CH3 CH3 CH3 CH3
CH3-CH• + Cl• → CH3-CH-CH3; Cl• + •Cl → Cl2
│ │
CH3 Cl
Побочный продукт: CH3-CH2-CH2Cl (1-хлорпропан).
Хлорирование метана и его гомологов сопровождается также образованием смеси моно- и полигалогенидов.
Бромирование протекает значительно медленнее, чем хлорирование. Иод с предельными углеводородами не реагирует. Фторирование элементарным фтором без растворителей приводит к взрыву. Даже при разбавлении фтора азотом или при ведении реакции в растворителях реакция протекает очень бурно. Поэтому для прямого фторирования чаще применяют вещества-генераторы фтора (трифтористый кобальт, четырехфтористый свинец) или проводят электролиз НF в присутствии фторируемого соединения.
В качестве примера реакции, протекающей также по радикальному механизму, рассмотрим реакцию нитрования алканов. Концентрированная азотная кислота окисляет алканы, а разбавленная НNO3, как показал М.И. Коновалов (1888), при нагревании и повышенном давлении способна взаимодействовать с алканами. Однако, скорость жидкофазного нитрования невелика и выходы нитросоединений низкие. Наилучшие результаты получаются с алканами, содержащими третичные углеродные атомы.
Пропан основные продукты: побочные продукты:
CH3 CH3-CH(NO2)-CH3 CH3-CH(OH)-CH3
│ HNO3
CH2 CH3-CH2CH2NO2 CH3-CH2CH2OH
│ 1400C
CH3 CH3-CH2NO2 CH3-CH2OH
CH3NO2 CH3NO2
Механизм реакции в жидкой фазе 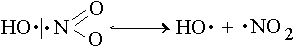 радикальный нецепной (SR):
радикальный нецепной (SR):
(зарождение или
инициирование цепи)
Инициатором является радикал •NO2. Рост цепи связывают с образованием углеводородных радикалов:
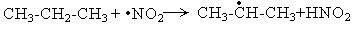
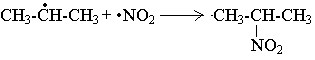
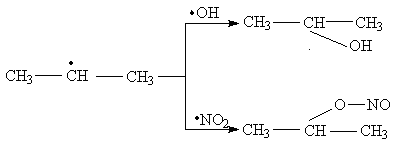
Побочно образуются спирты и эфиры азотистой кислоты (обрыв цепи):
Цепной радикальный процесс возникает при парофазном нитровании (при 250-4500С и давлении 0,8 – 1 МПа):
 (инициирование)
(инициирование)
Инициирование связано с гомолитическим разрывом С-Н связи в мо- лекуле углеводорода и образованием радикала •R, вызывающего рост цепной реакции, в которой попутно с образованием нитросоединения RNO2 -или спирта RОН образуются радикалы, разветвляющие цепь:
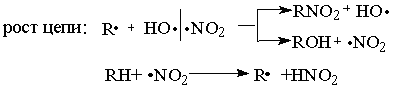
Обрыв цепи происходит при взаимодействии радикалов друг с другом:

Азотная кислота может быть заменена оксидами азота.
|
|
|
|
|
Дата добавления: 2014-12-26; Просмотров: 550; Нарушение авторских прав?; Мы поможем в написании вашей работы!