
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Политропные процессы
|
|
|
|
К политропным относятся термодинамические процессы, подчиняющиеся уравнению:
p·υn = const, (2.48)
где n = (с – cp)/(c – cv) – показатель политропы. Для конкретного политропного процесса величина n постоянна, но в различных политропных процессах показатель политропы может быть различным (в пределах ± ∞).
2.10.1 Соотношения политропного процесса. По аналогии с адиабатным процессом из уравнения (2.48) можно получить соотношения между параметрами политропного процесса:
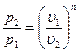 ;
;  ;
; 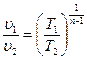 . (2.49)
. (2.49)
Также по аналогии с адиабатным процессом работа политропного процесса равна:
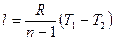 , (2.50)
, (2.50)
или с учетом уравнения состояния идеального газа:
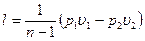 , (2.51)
, (2.51)
Подведенная теплота и изменение внутренней энергии в политропном процессе определяются уравнениями:
q = c (T 2 – T 1), (2.52)
Δ u = c υ (T 2 – T 1). (2.53)
Политропный процесс является обобщающим по отношению к основным термодинамическим процессам. Из уравнения (2.48) могут быть получены уравнения для различных термодинамических процессов: изотермического (n = 1), изобарного (n = 0), адиабатного (n = k) и изохорного (n = ± ∞).
2.10.2 Теплоемкость политропного процесса. Подставляя значения l, q и Δ u из (2.50), (2.52) и (2.53) в уравнение первого закона термодинамики, получим:
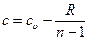 ,
,
или:
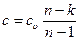 . (2.54)
. (2.54)
Видно, что теплоемкость в политропном процессе имеет вполне определенную величину, зависящую от значений с υ, k и n. Причем в зависимости от показателя политропы, теплоемкость может быть положительной или отрицательной, а в отдельных случаях равна нулю (в адиабатном процессе) или бесконечности (в изотермическом процессе).
2.10.3 Политропные процессы в р – υ диаграмме. Если на диаграмме р – υ выбрать некоторую точку О и провести из нее основные термодинамические процессы как в сторону расширения (dυ > 0), так и в сторону сжатия (dυ < 0), то диаграмма разделится на несколько областей. В каждой области расположены процессы, объединенные общностью определенных свойств (рис. 2.11).
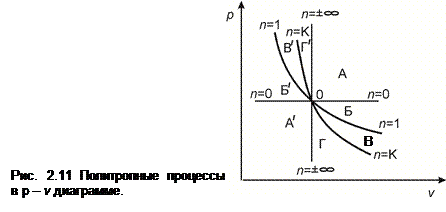 |
1. В областях А и А ’ располагаются политропные процессы, исходящие из точки О, у которых 0 > n > - ∞, в областях Б и Б ´: 1 > n > 0, в областях В и В ´: k > n >1 и в областях Г и Г ´: ∞ > n > k.
2. Все процессы, исходящие из точки О и расположенные правее изохоры (в областях А, Б, В, Г), совершают положительную работу (здесь dυ > 0) а расположенные левее изохоры (области А ´, Б ´, В ´, Г ´) – отрицательную (здесь dυ <0).
3. Все процессы, исходящие из точки О и расположенные выше изотермы (области В ’, Г ' А, Б), протекают с ростом температуры, а, следовательно, с ростом внутренней энергии, а процессы, расположенные ниже изотермы (области В, Г, А’, Б’) – с понижением Т и u. Это обусловлено тем, что, состояние газа в точках диаграммы р - υ, лежащих выше изотермы, исходящей из точки О, соответствует условию Т > Т 0.
4. Все процессы, выходящие из точки О и расположенные выше адиабаты (области Г ´, А, Б, В), протекают с подводом теплоты, а расположенные ниже адиабаты (области Г, А ´, Б ´, В ´) – с отводом теплоты. Например, изотермическое расширение газа идет с подводом теплоты, причем изотерма расширения расположена выше адиабаты.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 774; Нарушение авторских прав?; Мы поможем в написании вашей работы!