
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изохорный процесс
|
|
|
|
ИССЛЕДОВАНИЕ ТЕРМОДИНАМИЧЕСКИХ ПРОЦЕССОВ
ЭНТАЛЬПИЯ
Энтальпией называется термодинамическая функция, равная сумме внутренней энергии и произведения p·υ:
i = u + p·υ. (2.19)
Величина p·υ представляет собой работу, которую необходимо совершить для введения тела объемом υ во внешнюю среду, имеющую давление p. Поскольку в правой части оба слагаемых являются функциями состояния, то энтальпия также является функцией состояния.
Из (2.19) следует:
di = du + d (p·υ). (2.20)
Для идеального газа p·υ = R·T и du = cυ·dT, поэтому, в этом случае имеем
di = cр · dT, (2.21)
Δ i = i2 – i 1 = cр (T 2 – T 1). (2.22)
Подставляя du из (2.20) в (2.12) получим другую запись уравнения первого закона термодинамики:
dq = di – υ·dp, (2.23)
Последнее выражение для идеального газа с учетом (2.21) можно также представить так:
dq = cр dT – υ·dp. (2.24)
Основными задачами исследования термодинамических процессов являются изучение закономерностей изменения состояния рабочего тела и выявление особенностей превращения энергии. Последнее связано с определением теплоты, работы и изменения внутренней энергии в термодинамическом процессе. При исследовании термодинамических процессов рассматриваются равновесные процессы, поскольку только в этом случае они могут быть описаны соответствующими термодинамическими уравнениями. Методика исследования процессов предусматривает решение следующих вопросов:
- установление уравнения процесса;
- нахождение связи между параметрами состояния в исследуемом процессе;
-определение теплоты, работы, изменения внутренней энергии и энтальпии в процессе.
Для термодинамического исследования различных энергетических систем большое значение имеют закономерности основных термодинамических процессов, которые рассмотрены ниже.
Изохорными называются термодинамические процессы, протекающие в системе при постоянном объеме. Уравнением изохорного процесса является уравнение υ = const, а его графиком – вертикаль на p-v диаграмме (рис. 2.6). Очевидно, что процесс 1-2 (рис. 2.6) сопровождается подводом теплоты к газу (+ q), а процесс 2-1 – отводом (- q).
 |
Из уравнений состояния, записанных для начального и конечного состояний газа в этом процессе, p 1 υ = R·T 1 и p 2· υ = R·T2, следует:
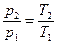 . (2.25)
. (2.25)
Поскольку при υ = const, удельная работа процесса l равна 0, то подведенная теплота
q = Δ u = cυ (T 2 - T 1). (2.26)
Следовательно, в изохорном процессе вся теплота, сообщенная газу, идет на изменение его внутренней энергии.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 1130; Нарушение авторских прав?; Мы поможем в написании вашей работы!