
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Внутренняя энергия
|
|
|
|
Под внутренней энергией термодинамической системы понимают энергию, которая заключена в самой системе. Внутренняя энергия тела включает сумму кинетической энергии поступательного, вращательного и колебательного движения молекул, кинетическую энергию колебательного движения атомов молекулы относительно друг друга и потенциальную энергию сил взаимодействия молекул, т.е. u = u кин + u пот. Энергия электронных оболочек атомов и внутриядерная энергия в термодинамических процессах не учитываются и в понятие внутренней энергии не включаются. Внутренняя энергия идеального газа включает только кинетическую энергию молекул и атомов газа, а в реальных газах следует учитывать также и потенциальную энергию межмолекулярного взаимодействия частиц.
Как следует из молекулярно-кинетической теории газов, кинетическая энергия поступательного движения молекул и атомов является однозначной функцией температуры (п. 1.2). Потенциальная энергия реального газа определяется силами взаимодействия между молекулами и зависит от среднего расстояния между молекулами, т.е. от объема или давления газа.
Исходя из задач и методов термодинамики, нет необходимости детально определять отдельные составляющие энергии микрочастиц и знать абсолютное значение внутренней энергии. Важно знать лишь изменение внутренней энергии тела (системы) в изучаемом процессе. Поэтому, в каждом случае рассматривается изменение лишь той составляющей внутренней энергии, которая претерпевает изменение. В технике важно знать не абсолютное значение внутренней энергии, а ее изменение в термодинамических процессах. В идеальном газе при отсутствии каких-либо реакций изменение внутренней энергии Δ u = Δ u кин., а в реальном газе Δ u = Δ u кин.. + Δ u пот.
Внутренняя энергия, как отмечалось, является функцией состояния, следовательно, она определяется заданием двух параметров состояния, т.е. u = f (p, T), u = φ (p, υ), или u = ψ (υ, T). Поэтому если тело переходит из состояния 1 (р 1, Т 1) в состояние 2 (р 2, Т 2), то независимо от пути термодинамического процесса, изменение внутренней энергии всегда одно и то же:
Δ u = u 2 – u 1 = f (p2, T 2) – f (p 1, T 1). (2.4)
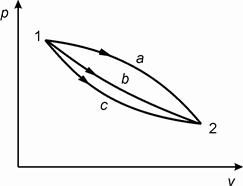
Если рассмотреть различные термодинамические процессы a, b и c (рис. 2.2), имеющие общие начальные и конечные состояния, но различный путь, то для всех процессов изменение внутренней энергии будет одинаковым:
 .
.
В круговых процессах (циклах), в результате которых тело возвращается в исходное состояние, изменение внутренней энергии равно нулю:
 .
.
Таким образом, для внутренней энергии характерно то, что ее изменение не зависит от пути процесса, а определяется только начальным и конечным состоянием тела (системы). Любая термодинамическая функция, обладающая этим свойством, называется функцией состояния. Термодинамические функции, не подчиняющиеся указанному условию, являются функциями процесса.
Рассмотрим внутреннюю энергию идеального газа. Выше было указано, что для идеального газа
Δ u = Δ u кин..
Внутренняя кинетическая энергия, как известно, зависит только от температуры. Поэтому для идеального газа
Δ u = u 2 – u 1 = f (T 2) – f (T 1). (2.5)
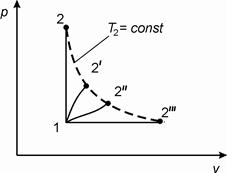
Рассмотрим несколько процессов перехода идеального газа из состояния 1 с температурой Т 1 в состояния 2, 2´, 2´´, 2´´´, которые характеризуются одинаковой температурой Т 2 (изотерма на рис. 2.3). Во всех процессах (обозначим их υ, d, e, p) температуры Т 1 и Т 2 одинаковы, поэтому одинаково и изменение внутренней энергии:
Δ uυ = Δ ud = Δ ue = Δ up, (2.6)
Рассмотрим процесс 1 - 2. В нем υ = const и, следовательно, удельная работа l =0. Поэтому согласно (2.2) имеем qυ = Δ uυ, но т.к. q υ = сυ (T 2 – T 1), то:
Δ uυ = сυ (T 2 – T 1), (2.7)
Таким образом, на основании уравнений (2.6) и (2.7) для идеального газа можно записать Δ uυ =Δ uр =Δ ud = Δ uе = сυ (T 2 – T 1) = сυ ·Δ T. Следовательно, изменение внутренней энергии идеального газа во всех рассмотренных процессах равно:
Δ u = сυ Δ T, (2.8)
или в дифференциальной форме,
du = сυ dT (2.9)
Поскольку для идеального газа сυ = const, то изменение внутренней энергии в термодинамическом процессе пропорционально изменению температуры в нем.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 726; Нарушение авторских прав?; Мы поможем в написании вашей работы!