
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Работа и теплота процесса
|
|
|
|
Как отмечалось выше, работа и теплота представляют собой две различные формы обмена энергией.
2.3.1 Работа. Рассмотрим равновесный процесс расширения газа в цилиндре с поршнем. Пусть изменение состояния газа в цилиндре изображается в координатах р, υ кривой 1-2 (рис. 2.4). Газ, расширяясь, совершает работу против внешних сил. Нетрудно видеть, что при бесконечно малом перемещении поршня на расстояние dx работа, совершаемая газом, равна:
dL = p·F·dx = p·dV,
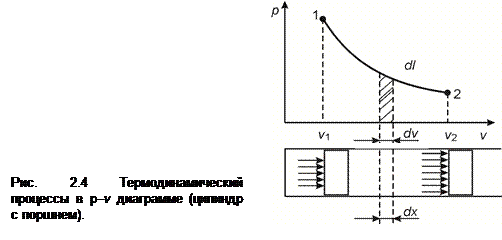
где F - площадь поршня, а работа, совершаемая газом в процессе 1-2. Полная работа, совершаемая газом в процессе 1-2, вычисляется из уравнения 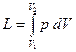 .
.
 |
Для 1 кг газа удельная работа равна:
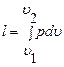 , (2.10)
, (2.10)
а в элементарном процессе:
dl = p·dυ, (2.11)
где υ – удельный объем. Очевидно, что удельная работа l в p−υ координатах, эквивалентна площади υ 1 -1-2-υ 2, расположенной под кривой термодинамического процесса 1-2.
В термодинамике газовых потоков принято следующее правило знаков: работа, совершаемая рабочим телом над внешней средой (работа расширения, dυ > 0), считается положительной, а работа, совершаемая внешней средой над рабочим телом (работа сжатия, dυ < 0) – отрицательной.
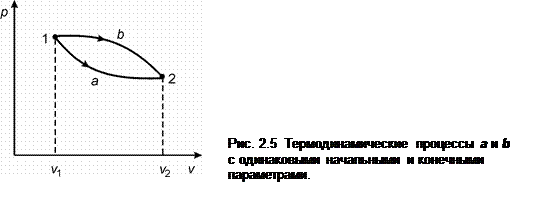
Рассмотрим два процесса перехода тела из состояния 1 в состояние 2 (рис. 2.5). Хотя в процессах a и b исходные и конечные состояния тела одинаковы, но величина работы в этих процессах различна. Таким образом, величина работы зависит от пути процесса, т.е. она является функцией процесса. С учетом (2.11) уравнение первого закона термодинамики можно представить так:
dq = du + p·dυ, (2.12)
а для идеального газа с учетом (2.9):
 dq = cυ · dT + p·dυ. (2.13)
dq = cυ · dT + p·dυ. (2.13)
Аналогичные выражения можно получить и для уравнений первого закона термодинамики в интегральной форме.
2.3.2 Теплота. Так как удельная работа l зависит от пути процесса, а величина Δ u не зависит от него, то из (2.2) следует, что теплота является функцией процесса, т.е. ее величина зависит от пути термодинамического процесса. В термодинамике газовых потоков принято следующее правило знаков: теплота, подведенная к телу, считается положительной, а отведенная от него – отрицательной.
Определение количества теплоты – важный элемент расчета термодинамического процесса. Наиболее просто эта задача решается при постоянной теплоемкости процесса:
q = c· (T 2 – T 1). (2.14)
В случае переменной теплоемкости возможны различные способы расчета.
Расчет с помощью формул теплоемкости. Из (1.5) следует:
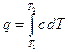 . (2.15)
. (2.15)
Подставив значение истинной теплоемкости c = a + b·t + d·t 2 в уравнение (2.15) и проинтегрировав его, получим
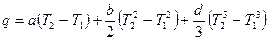 . (2.16)
. (2.16)
Расчет с использованием значений средних теплоемкостей. Из (1.6) следует:
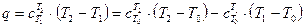
Если перейти от градусов Кельвина к градусам Цельсия и использовать в качестве начального значения температуру t0 = 0ºC, то будем иметь:
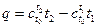 . (2.17)
. (2.17)
Для расчета по уравнению (2.17) необходимы данные по средним значениям теплоемкости 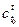 , которые представлены в виде таблиц, графиков и т.д.
, которые представлены в виде таблиц, графиков и т.д.
Расчет с использованием истинной теплоемкости. Для многих газов в достаточно широком интервале температур зависимость теплоемкости от температуры является практически линейной: c = a + b T. Подставив это уравнение в (2.15) и проинтегрировав его, получим:
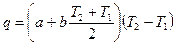 ,
,
Здесь первый сомножитель представляет собой истинную теплоемкость при средней температуре Т ср. = 0,5(Т 2 + Т1). Следовательно, в данном случае теплота может быть найдена по формуле:
q = c Тср. (T 2 – T 1), (2.18)
где c Тср. – истинная теплоемкость при температуре Тср. Указанные способы учета переменности теплоемкости могут быть использованы не только для определения величины q, но и для нахождения других величин, например, изменения внутренней энергии.
В заключение отметим, что при определении теплоты процесса следует использовать величину теплоемкости, которая соответствует данному процессу. Например, для процесса p = const при постоянной теплоемкости имеем: q = cр (T 2 - T 1), а для процесса υ = const: q = cυ (T 2 - T 1).
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 1153; Нарушение авторских прав?; Мы поможем в написании вашей работы!