
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энтропийные диаграммы реального газа
|
|
|
|
Для анализа и расчетов термодинамических процессов, происходящих в реальных газах, удобно использовать энтропийные диаграммы. Наиболее широкое распространение получили T – s - и i – s диаграммы.
7.3.1 Диаграмма T – s. Примерный вид T – s - диаграммы реального газа приведен на рис.7.7. Так же, как и на p – v - диаграмме, здесь нанесены пограничные кривые пара (линия К - с) и жидкости (b - K). Область диаграммы, ограниченная справа пограничной кривой жидкости, а сверху – критической изотермой, является областью жидкого состояния вещества. Область, расположенная между пограничными кривыми является областью двухфазного состояния вещества «жидкость-пар». Справа и вверх от пограничной кривой пара расположена область газообразного состояния. В области двухфазного состояния («жидкость-пар»), т.е. между двумя пограничными кривыми, наносятся линии постоянной сухости пара, x=const.
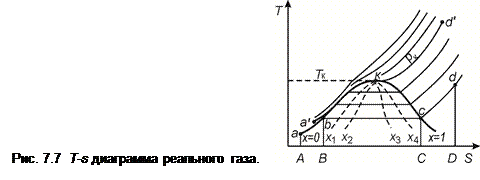
Изобара a-b-c-d на Т – s диаграмме при докритических давлениях имеет три характерных участка, соответствующих процессам нагрева жидкости, парообразования и перегрева пара. На участке парообразования b-c (т.е. двухфазного состояния) изобара совпадает с изотермой; поэтому на T – s диаграмме она представляет собой горизонтальную прямую. Для определения характера протекания изобар на участках подогрева жидкости (a-b)и перегрева пара (c-d) можно использовать величину тангенса угла наклона касательной к изобаре в Т - s координатах, которая определяется уравнением:
 .
.
При докритических давлениях теплоемкость сравнительно мало изменяется с температурой, поэтому величина tg βp с ростом температуры увеличивается. Изобары в рассматриваемых областях диаграммы представляют собой кривые, обращенные выпуклостью к оси абсцисс. При докритических давлениях изобары жидкости в T-s диаграмме проходят вблизи пограничной кривой жидкости и поэтому часто не изображаются на диаграмме.
В состояниях, близких к критической точке, рост теплоемкости на отдельных участках происходит значительно интенсивнее увеличения температуры (рис. 7.1). На этих участках с повышением температуры величина tg βp уменьшается и изобара обращена выпуклостью к оси абсцисс. При давлениях, значительно превосходящих критическую величину, теплоемкость сравнительно мало меняется с температурой и изобары в этом случае также представляют собой кривые, обращенные выпуклостью к оси абсцисс. Изобара критического давления a’·K·d’ не имеет горизонтального участка (участка парообразования); в этой точке имеется перегиб этой кривой, т.к. 
В T - s диаграмме полученное (отданное) количество теплоты определяется площадью под кривой процесса. Если, например, рассмотреть изобарный процесс a-b-c-d, то теплота процесса нагрева жидкости от начальной температуры до температуры кипения изображается площадью a-b-В-А, теплота процесса парообразования – площадью b-c-С-В, а теплота перегрева пара – площадью c-d-D-C. Для удобства пользования T, s -диаграммой на ней также нанесены сетки изохор, а также линий постоянных энтальпий.
7.3.2 Диаграмма i – s. Общий вид i – s диаграммы реального газа показан на рис. 7.8. На диаграмму наносятся пограничные кривые жидкости (x = 0) и пара (x = 1,0), изобары, изотермы и изохоры. Между пограничными кривыми располагается область влажного насыщенного пара, в которой наносятся линии x = const. Область диаграммы, расположенная левее пограничной кривой жидкости и ниже критической изотермы, является областью жидкого состояния. Остальная часть диаграммы соответствует перегретому пару.

Общий вид изобар на диаграмме i – s можно установить, рассмотрев тангенс угла наклона касательной к изобаре в i – s - координатах:

В критической точке производная равна Т к , т.е. имеет положительное значение; поэтому критическая точка лежит на восходящей части пограничной кривой (рис. 7.8). В области подогрева жидкости, поскольку температура в этом процессе увеличивается, изобара будет изображаться кривой, обращенной выпуклостью к оси абсцисс. В области влажного насыщенного пара изобары являются одновременно изотермами, и поэтому представляют собой прямые линии с угловым коэффициентом, равным абсолютной температуре насыщенного пара. Изобары больших давлений имеют большой угол наклона, т. к. они соответствуют большим температурам, в этом случае изобары в области влажного пара изображаются веерообразно расходящимся пучком прямых линий.
В точке пересечения с пограничной кривой пара изобары парообразования плавно переходят в изобары перегрева пара. Поскольку температура в процессе перегрева пара увеличивается, то изобары в этой области представляют собой кривые, обращенные выпуклостью к оси абсцисс. Вид изотерм определяется температурой, которой они соответствуют. Чем больше температура, тем выше располагается изотерма. Изотермы пересекают пограничные кривые с изломом. По мере удаления от пограничной кривой (х = 1,0) изотерма приближается к горизонтали, соответствующей i = const, т. к. в этой области пар становится близким по своим свойствам к идеальному газу, у которого энтальпия однозначно определяется температурой.
Как указывалось в гл. 3, особенности i - s диаграммы делают ее удобной для проведения расчетов и анализа термодинамических процессов. Это особенно важно в случае реальных газов, для которых аналитические расчеты затруднены из-за отсутствия точного уравнения состояния. Порядок определения основных термодинамических величин для заданного процесса такой же, как в случае идеальных газов (гл. 3).
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 1737; Нарушение авторских прав?; Мы поможем в написании вашей работы!