
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Диффузионная устойчивость
|
|
|
|
Термическая устойчивость.
Механическая устойчивость.
Для однокомпонентного флюида при заданной температуре возможные изменения состояния сводятся к изменению плотности (молярного объёма).
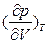 <0,
<0,
Состояния, для которых 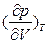 >0, являются лабильными, нереализуемыми.
>0, являются лабильными, нереализуемыми.
 >0, или
>0, или 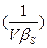 >0,
>0,
На языке химических потенциалов условия устойчивости бинарного раствора формулируются как
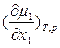 >0;
>0; 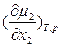 >0,
>0,
то есть, химический потенциал компонента и его молярная доля в устойчивой бинарной системе должны изменяться симбатно (в одну сторону).
Общая формулировка диффузионной устойчивости в случае  -компонентной системы, записанная через химических потенциал имеет вид:
-компонентной системы, записанная через химических потенциал имеет вид:
 >0,
>0,
На предыдущей лекции мы говорили о метастабильном состоянии, как предтечи фазового перехода.
Для системы жидкость – пар, используя уравнение состояния Ван-дер-Ваальса, мы объяснили возникновение метастабильного состояния.
Голландский физик Ван-дер-Ваальс в своей диссертации "Непрерывность газообразного и жидкого состояния" (1873 г.) впервые решил задачу получения уравнения состояния, которое описывало бы поведение всех реальных газов. Это уравнение состояния учитывает объём и взаимодействие молекул (силы притяжения и отталкивания между молекулами).
Простые и не очень строгие рассуждения привели к уравнению вида
 или
или 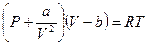 (*)
(*)
Уравнение называется уравнением состояния Ван-дер-Ваальса. Вывод сделан на основе качественных рассуждений о молекулярном объёме " b " и межмолекулярных силах притяжения, величина которых пропорциональна квадрату плотности газа.
В критической точке
 ,
, 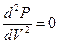
|
|
|
|
|
Дата добавления: 2014-12-23; Просмотров: 749; Нарушение авторских прав?; Мы поможем в написании вашей работы!