
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Схемы фазовых превращений однокомпонентных систем
|
|
|
|
СХЕМЫ ФАЗОВЫХ ПРЕВРАЩЕНИЙ УГЛЕВОДОРОДОВ
В процессе эксплуатации месторождений в пластах непрерывно изменяются давление, количественное соотношение газа и нефти, а иногда и температура. Это сопровождается непрерывными изменениями состава газовой и жидкой фаз и переходом различных угле-
водородов из одной фазы в другую.
Познание закономерностей фазовых переходов и фазовых состояний газонефтяных смесей начнём с познания закономерностей фазовых переходов и фазовых состояний однокомпонентных веществ.

Рис. 3. Диаграммы фазового состояния чистого этана.
участка. Справа от пунктирной линии отрезок соответствует газовой фазе, горизонтальный участок — двухфазной газожидкостной области и левый участок — жидкой фазе. Отрезок пунктирной кривой вправо от максимума в точке 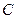 называется кривой точек конденсации (или точек росы), а влево от максимума — кривой точек парообразования (кипения). В точке
называется кривой точек конденсации (или точек росы), а влево от максимума — кривой точек парообразования (кипения). В точке 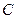 пунктирной линии кривые парообразования и конденсации сливаются. Эта точка называется критической.
пунктирной линии кривые парообразования и конденсации сливаются. Эта точка называется критической.
С приближением давления и температуры к их критическим значениям свойства газовой и жидких фаз становятся одинаковыми, поверхность раздела между ними исчезает, и плотности их уравниваются. Следовательно, с приближением к критической точке по кривой начала кипения плотность жидкой фазы будет непрерывно убывать. Если же к ней приближаться по линии точек конденсации, то плотность пара будет непрерывно возрастать.
Для изотермических фазовых превращений однокомпонентных газов характерно постоянство давления в двухфазной области, т. е. после начала конденсации газа дальнейшее превращение его в жидкость с уменьшением объема системы происходит при постоянном давлении до тех пор, пока весь газ не превратится в конденсат.
Точно также со снижением давления после начала парообразования дальнейшее кипение (испарение) жидкой фазы происходит при постоянном давлении.
Обе фазы (жидкость и пар) при данной температуре присутствуют в системе только в том случае, если давление равно упругости насыщенного пара этой жидкости.
Фазовые превращения углеводородов можно представить также в координатах давление 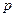 — температура
— температура 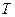 (рис. 3, б). Для однокомпонентной системы кривая давления насыщенного пара на графике давление - температура является одновременно кривой точек начала кипения и линией точек росы.
(рис. 3, б). Для однокомпонентной системы кривая давления насыщенного пара на графике давление - температура является одновременно кривой точек начала кипения и линией точек росы.
При всех других давлениях и температурах, значения которых не располагаются на этой кривой, вещество находится в однофазном состоянии - в жидком, если при данной температуре давление выше кривой давления насыщенного пара. Если при той же температуре давление ниже давления насыщенного пара, вещество находится в паровой или газовой фазе в ненасыщенном состоянии.
Фазовая диаграмма индивидуальных углеводородов в координатах давление — температура ограничивается критической точкой 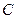 . Для однокомпонентных систем эта точка определяется наивысшими значениями давления и температуры, при которых еще могут существовать две фазы одновременно. Величины критических давлений и температур основных компонентов природного газа приведены в табл. 2.
. Для однокомпонентных систем эта точка определяется наивысшими значениями давления и температуры, при которых еще могут существовать две фазы одновременно. Величины критических давлений и температур основных компонентов природного газа приведены в табл. 2.
Из рис. 3, б видно, что путем соответствующих изменений давления и температуры углеводороды можно перевести из парообразного состояния в жидкое, минуя двухфазную область. Действительно, газ, характеризующийся параметрами в точке  , можно путем изобарического нагрева довести до температуры в точке
, можно путем изобарического нагрева довести до температуры в точке  , а затем, повысив давление в системе при постоянной температуре, перевести вещество в область (точка
, а затем, повысив давление в системе при постоянной температуре, перевести вещество в область (точка  ), расположенную выше критической точки
), расположенную выше критической точки 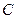 , и далее в область точки
, и далее в область точки 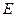 . Свойства системы при этом изменяются непрерывно и разделения углеводорода на фазы не произойдет. При дальнейшем охлаждении системы (от точки
. Свойства системы при этом изменяются непрерывно и разделения углеводорода на фазы не произойдет. При дальнейшем охлаждении системы (от точки  до точки
до точки 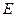 ), а затем и при снижении давления до значения в точке
), а затем и при снижении давления до значения в точке 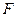 вещество приобретает свойства жидкости, минуя область двухфазного состояния вещества.
вещество приобретает свойства жидкости, минуя область двухфазного состояния вещества.
Значительно сложнее закономерности фазовых переходов двух и многокомпонентных систем.
|
|
|
|
|
Дата добавления: 2014-12-23; Просмотров: 1029; Нарушение авторских прав?; Мы поможем в написании вашей работы!