
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Физические свойства
|
|
|
|
Строение карбоксильной группы.
Карбоксильная группа имеет карбонильную группу, но при этом же атоме находится гидроксильная группа.
В карбонильной группе атом углерода несет частичный положительный заряд и притягивает неподеленную электронную пару атома кислорода в группе О-Н (положительный мезомерный эффект). При этом электронная плотность на атоме кислорода уменьшается и связь О-Н ослабляется. Этот эффект определяет кислотные свойства карбоновых кислот. В свою очередь, группа ОН “гасит” положительный заряд на углероде карбонильной группы, последняя теряет способность к реакциям присоединения, характерным для карбонильных соединений. Важнейшими реакциями карбоновых кислот является их взаимодействие с нуклеофильными агентами.
Первые четыре представителя ряда монокарбоновых кислот - жидкости, смешивающиеся с водой во всех отношениях. Кислоты, в молекуле которых содержится от пяти до девяти атомов углерода, а также изомасляная кислота, жидкости, но мало растворимые в воде. Высшие кислоты от С10 - твердые вещества, практически не растворимые в воде. Кислоты обладают более высокими температурами кипения и плавления по сравнению со спиртами с тем же числом углеродных атомов, это обусловлено образованием циклических димеров (за счет двух водородных связей).
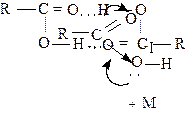 |
Химические свойства карбоновых кислот.
Карбоновые кислоты являются слабыми кислотами по сравнению с минеральными, но сильнее, чем спирты, поскольку атом водорода в карбоксильной группе обладает повышенной подвижностью из-за +М эффекта гидроксильной группы. В водном растворе карбоновые кислоты диссоциируют:

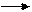

 RCOOH+H2O RCOO- + H3O+
RCOOH+H2O RCOO- + H3O+
Легкость диссоциации объясняется двумя причинами. Первая причина уже упоминалась, и объясняется эффектом сопряжения гидроксильной группы с карбонильной группой. Вторая причина заключается в том, что образующийся карбоксилат-ион стабилизирован сопряжением, и строение этого аниона может быть представлено следующими способами:

Карбоновые кислоты реагируют с металлами, основными оксидами, гидроксидами, с солями более слабых кислот, аммиаком и аминами. Так, карбоновая кислота сильнее угольной и вытесняет ее из солей:
RCOOH + NaHCO3→ RCOONa + CO2 + H2O
Выделение газа при обработке органического вещества насыщенным раствором гидрокарбоната натрия - качественная реакция на карбоновые кислоты, она позволяет отличить их от фенолов.
Карбоновые кислоты являются основаниями по Льюису и при действии кислоты протонируются:

Эта реакция является основным условием вступления карбоновых кислот в реакции нуклеофильного замещения, а именно, замещения гидроксильной группы на группы: алкоксильную -OR’, получение сложных эфиров карбоновых кислот общей формулы RCOOR’, на аминогруппу -NH2, получение амидов кислот общей формулы RCONH2, на анион кислоты -OCOR’, получение ангидридов кислот общей формулы RCOOCOR’.
Некоторые из этих производных, например, сложные эфиры, амиды, ангидриды кислот, имеют большое биологическое значение.
Взаимодействие карбоновой кислоты со спиртом называется реакцией этерификации. Эта реакция проводится в присутствии кислотного катализатора (серная, хлороводородная кислоты).

Эта реакция обратимая, чтобы сместить равновесие вправо, либо отгоняют сложный эфир, либо связывают воду, применяя в качестве катализатора кислоты (H2SO4), хорошо поглощающие воду.
Механизм реакции этерификации на примере синтеза этилацетата, этилового эфира уксусной кислоты.

 CH3COOH + C2H5OH CH3COOC2H5 +H2O
CH3COOH + C2H5OH CH3COOC2H5 +H2O

По аналогичному механизму образуются амиды, ангидриды кислот.
Реакция декарбоксилирования.
Карбоновые кислоты декарбоксилируются. Легкость декарбоксилирования карбоновых кислот зависит от структуры последних. Любые электроноакцепторные заместители облегчают декарбоксилирование. Так, декарбоксилирование уксусной кислоты происходит в жестких условиях (при сплавлении ацетата натрия с щелочью), а декарбоксилирование кетопропионовой (пировиноградной) кислоты или нитроуксусной кислоты происходит легко при нагревании водных щелочных растворов:
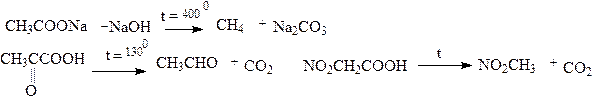 |
Декарбоксилирование пировиноградной кислоты является промежуточным звеном при молочнокислом и спиртовом брожении углеводов.
В карбоновых кислотах водороды a-метиленового звена обладают подвижностью, хотя меньшей, чем в альдегидах и кетонах (ср. эффекты), но в определенных условиях могут замещаться. Так, при действии хлора или брома в присутствии фосфора на карбоновые кислоты или на их хлорангидриды происходит замещение a- водородных атомов:
 СH3-CH2- CH2-COOH + Br2 CH3CH2CHBr COOH + HBr
СH3-CH2- CH2-COOH + Br2 CH3CH2CHBr COOH + HBr
α –броммасляная
кислота
Эта реакция открывает большие синтетические возможности, так как галоген легко вступает в реакции нуклеофильного замещения и может быть заменен на гидроксигруппу, аминогруппу и др.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 1076; Нарушение авторских прав?; Мы поможем в написании вашей работы!