
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Окислительно-восстановительные реакции. Гидролизом называют процесс взаимодействия вещества с водой, при котором составные части веществ соединяются с составными частями воды
|
|
|
|
Гидролиз солей.
Гидролизом называют процесс взаимодействия вещества с водой, при котором составные части веществ соединяются с составными частями воды.
Гидролиз - это реакция, обратная реакции нейтрализации. В реакцию гидролиза вступают: соли, образованные слабой кислотой и слабым основанием, или слабой кислотой и сильным основанием, или слабым основанием и сильной кислотой. Соли, образованные сильной кислотой и сильным основанием гидролизу не подвергаются.
Растворы солей, образованных слабой кислотой и сильным основанием имеют щелочную реакцию, а растворы солей, образованные сильной кислотой и слабым основанием имеют кислую реакцию, причём чем слабее кислота или основание в рассматриваемом случае, тем в большей степени подвергаются гидролизу образованные ими соли.
Виды Гидролиза Различают несколько видов гидролиза солей:
1. Гидролиз соли слабой кислоты и сильного основания:
Na2CO3 + Н2О = NaHCO3 + NaOH
CO32- + H2O = HCO3- + OН-
(раствор имеет щелочную реакцию, реакция протекает обратимо)
2. Гидролиз соли сильной кислоты и слабого основания:
СuСl2 + Н2О = CuOHCl + HCl
Cu2+ + Н2О = CuOH+ + Н+
(раствор имеет кислую реакцию, реакция протекает обратимо)
3. Гидролиз соли слабой кислоты и слабого основания:
Al2S3 + 6H2O = 2Al(OН)3 + 3H2S
2Аl3+ + 3S2- + 6Н2О = 2Аl(OН)3 + ЗН2S
(Гидролиз в этом случае протекает практически полностью, так как оба продукта гидролиза уходят из сферы реакции в виде осадка или газа).
Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален.
Поскольку соль состоит из катиона и аниона, то возможно три типа гидролиза:
гидролиз по катиону (в реакцию с водой вступает только катион);
гидролиз по аниону (в реакцию с водой вступает только анион);
совместный гидролиз (в реакцию с водой вступает и катион, и анион).
32) окислительно востановительные реакции, основные понятия химический источник тока электролиз
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ (р-ции окисления-восстановления) происходят с изменением степени окисления атомов, входящих в состав реагирующих в-в. При окислении в-в степень окисления элементов возрастает, при восстановлении - понижается.
а) Окислением называют процесс отдачи электронов атомам, молекулам или ионам. Степень окисления при этом повышается.
б) Восстановлением называют процесс присоединения электронов атомом, молекулой или ионом. Степень окисления при этом понижается.
в) Атомы, молекулы и ионы, отдающие электроны называются восстановителями. Сами они при этом окисляются.
Атомы, молекулы и ионы, присоединяющие электроны называются окислителями. Сами они при этом восстанавливаются.
г) Окисление всегда сопровождается восстановлением (и наоборот).
Правило электронного баланса: число электронов, отдаваемых молекулами, атомами или ионами восстановителя, равно числу электронов, присоединенных молекулами, атомами или ионами окислителя.
Существуют 2 метода составления уравнений окислительно-восстановительных реакций:
а) метод электронного баланса, основанный на сравнении степеней окисления атомов в исходных и конечных веществах. В основе этого метода лежит закон сохранения электрического заряда.
б) метод полуреакций (метод ионно-электронного баланса), основанный на составлении ионных уравнений для процессов окисления восстановителя и восстановления окислителя с последующим суммированием их в общее уравнение. В основе этого метода лежат законы сохранения массы и закон сохранения электрического заряда.
В периодах периодической системы с повышением порядкового номера элемента восстановительные свойства групп веществ понижаются, а окислительные - возрастают. В группах периодической системы с повышением порядкового номера элемента возрастают восстановительные свойства веществ, а окислительные - убывают.
Окислителями могут быть соединения высших, а восстановителями - низших степеней окисления, присущих данному элементу.
Химический источник тока электролиз
Химические источники тока устройства, вырабатывающие электрическую энергию за счёт прямого преобразования химической энергии окислительно-восстановительных реакций. Первые Х. и. т. созданы в 19 в. (Вольтов столб, 1800; элемент Даниела - Якоби, 1836; Лекланше элемент, 1865, и др.). До 60-х гг. 19 в. Х. и. т. были единственными источниками электроэнергии для питания электрических приборов и для лабораторных исследований. Основу Х. и. т. составляют два электрода (один - содержащий окислитель, другой - восстановитель), контактирующие с электролитом. Между электродами устанавливается разность потенциалов - электродвижущая сила (эдс), соответствующая свободной энергии окислительно-восстановительной реакции. Действие Х. и. т. основано на протекании при замкнутой внешней цепи пространственно разделённых процессов: на отрицательном электроде восстановитель окисляется, образующиеся свободные электроны переходят по внешней цепи (создавая разрядный ток) к положительному электроду, где участвуют в реакции восстановления окислителя.
Электро́лиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор либо расплав электролита.
Примеры электролиза расплавов:
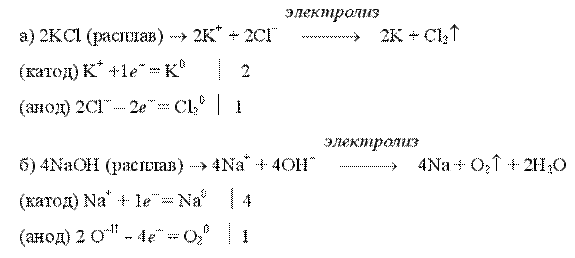
Электролиз воды проводится всегда в присутствии инертного электролита (для увеличения электропроводности очень слабого электролита - воды):
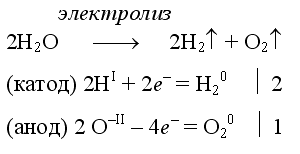
В зависимости от инертного электролита электролиз проводится в нейтральной, кислотной или щелочной среде. При выборе инертного электролита необходимо учесть, что никогда не восстанавливаются на катоде в водном растворе катионы металлов, являющихся типичными восстановителями (например Li+, Cs+, K+, Ca2+, Na+, Mg2+, Al3+) и никогда не окисляется на аноде кислород O−II анионов оксокислот с элементом в высшей степени окисления (например ClO4−, SO42−, NO3−, PO43−, CO32−, SiO44−, MnO4−), вместо них окисляется вода
Примеры электролиза растворов солей:

(на аноде окисляются анионы Сl−, а не кислород O−II молекул воды, так как электроотрицательность хлора меньше, чем кислорода, и следовательно, хлор отдает электроны легче, чем кислород)
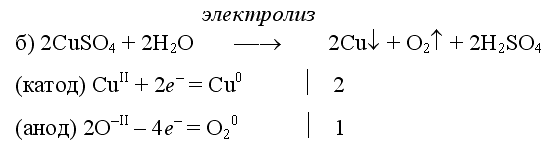
(на катоде восстанавливаются катионы Cu2+, а не водород HI молекул воды, так как медь стоит правее водорода в ряду напряжений, то есть легче принимает электроны, чем HI в воде).
Таким образом, электролиз - это окислительно-восстановительная реакция, которая протекает под действием и при участии электрического тока. Уравнения электрохимических реакций отражают те процессы, которые без помощи электрического тока протекать не могут.
33) дисперсное состояние вещества.
34) комплексные соединения общие свойства классификация номенклатура получения физич и химич свойства практическое использование.
Комплексные соединения (лат. complexus — сочетание, обхват), или координационные соединения (лат. co — «вместе» и ordinatio — «упорядочение») — частицы (нейтральные молекулы или ионы), которые образуются в результате присоединения к данному иону (или атому), называемому комплексообразователем, нейтральных молекул или других ионов, называемых лигандами. Теория комплексных соединений (координационная теория) была предложена в 1893 г. А. Вернером.
Комплексные соединения мало диссоциируют в растворе (в отличие от двойных солей). Комплексные соединения могут содержать комплексный малодиссоциирующий анион ([Fe(CN)6]3−), комплексный катион ([Ag(NH3)2]+) либо вообще не диссоциировать на ионы (соединения типа неэлектролитов, например карбонилы металлов). Комплексные соединения разнообразны и многочисленны.
Классификация
Существует несколько классификации комплексных соединений в основу которых положены различные принципы.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1064; Нарушение авторских прав?; Мы поможем в написании вашей работы!