
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Номенклатура. По числу мест занимаемых лигандами в координационной сфере
|
|
|
|
По природе лиганда
По числу мест занимаемых лигандами в координационной сфере
По заряду комплекса
1) Катионные комплексы образованы в результате координации вокруг положительного иона нейтральных молекул (H2O, NH3 и др.).
[(Zn(NH3)4)]Cl2 — хлорид тетраамминцинка(II)
[Co(NH3)6]Cl3 — хлорид гексоамминкобальта(II)
2) Анионные комплексы: в роли комплексообразователя выступает атом с положительной степенью окисления, а лигандами являются простые или сложные анионы.
K2[BeF4] — тетрафторобериллат(II) калия
Li[AlH4] — тетрагидридоалюминат(III) лития
K3[Fe(CN)6] — гексацианоферрат(III) калия
3) Нейтральные комплексы образуются при координации молекул вокруг нейтрального атома, а так же при одновременной координации вокруг положительного иона — комплексообразователя отрицательных ионов и молекул.
[Ni(CO)4] — тетракарбонилникель
[Pt(NH3)2Cl2] — дихлородиамминплатина(II)
1) Монодентатные лиганды. Такие лиганды бывают нейтральными (молекулы Н2О, NH3, CO, NO и др.) и заряженными (ионы CN−, F−, Cl−, OH−, SCN−, S2O32− и др.).
2) Бидентатные лиганды. Примерами служат лиганды: ион аминоуксусной кислоты H2N — CH2 — COO−, оксалатный ион −O — CO — CO — O−, карбонат-ион СО32−, сульфат-ион SO42−.
3) Полидентатные лиганды. Например, комплексоны — органические лиганды, содержащие в своем составе несколько групп −С≡N или −COOH (этилендиаминтетрауксусная кислота — ЭДТА). Циклические комплексы, образуемые некоторыми полидентатными лигандами, относят к хелатным (гемоглобин и др.).
1) Аммиакаты — комплексы, в которых лигандами служат молекулы аммиака, например: [Cu(NH3)4]SO4, [Co(NH3)6]Cl3, [Pt(NH3)6]Cl4 и др.
2) Аквакомплексы — в которых лигандом выступает вода: [Co(H2O)6]Cl2, [Al(H2O)6]Cl3 и др.
3) Карбонилы — комплексные соединения, в которых лигандами являются молекулы оксида углерода(II): [Fe(CO)5], [Ni(CO)4].
4) Ацидокомплексы — комплексы, в которых лигандами являются кислотные остатки. К ним относятся комплексные соли: K2[PtCl4], комплексные кислоты: H2[CoCl4], H2[SiF6].
5) Гидроксокомплексы — комплексные соединения, в которых в качестве лигандов выступают гидроксид-ионы: Na2[Zn(OH)4], Na2[Sn(OH)6] и др.
1) В названии комплексного соединения первым указывают анион|отрицательно заряженную часть — анион, затем положительную часть — катион.
2) Название комплексной части начинают с указания состава внутренней сферы. Во внутренней сфере прежде всего называют лиганды — анионы, прибавляя к их латинскому названию окончание «о». Например: Cl− — хлоро, CN− — циано, SCN− — тиоцианато, NO3− — нитрато, SO32− — сульфито, OH− — гидроксо и т. д. При этом пользуются терминами: для координированного аммиака — аммин, для воды — аква, для оксида углерода(II) — карбонил.
3) Число монодентатных лигандов указывают греческими числительными: 1 — моно (часто не приводится), 2 — ди, 3 — три, 4 — тетра, 5 — пента, 6 — гекса. Для полидентатных лигандов (например, этилендиамин, оксалат) используют бис-, трис-, тетракис- и т. д.
4) Затем называют комплексообразователь, используя корень его латинского названия и окончание -ат, после чего римскими цифрами указывают (в скобках) степень окисления комплексообразователя.
5) После обозначения состава внутренней сферы называют внешнюю сферу.
6) В названии нейтральных комплексных частиц комплексообразователь указывается в именительном падеже, а степень его не указывается, так как она однозначно определяется, исходя из электронейтральности комплекса.
Примеры:
K3[Fe(CN)6] — гексацианоферрат(III) калия
(NH4)2[PtCl4(OH)2] — дигидроксотетрахлороплатинат(IV) аммония
[Сr(H2O)3F3] — трифторотриаквахром
[Сo(NH3)3Cl(NO2)2] — динитрохлоротриамминкобальт
[Pt(NH3)4Cl2]Cl2 — хлорид дихлоротетраамминплатины(IV)
[Li(H2O)4]NO3 — нитрат тетрааквалития
35) теплоемкость теплопроводность и температуропроводность.
Теплоёмкость тела (обычно обозначается латинской буквой C) — физическая величина, определяющая отношение бесконечно малого количества теплоты δ Q, полученного телом, к соответствующему приращению его температуры δ T:
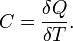 Единица измерения теплоёмкости в системе СИ — Дж/К.
Единица измерения теплоёмкости в системе СИ — Дж/К.
Удельной теплоёмкостью называется теплоёмкость, отнесённая к единичному количеству вещества. Количество вещества может быть измерено в килограммах, кубических метрах и молях. В зависимости от того, к какой количественной единице относится теплоёмкость, различают массовую, объёмную и молярную теплоёмкость.
Теплопрово́дность — это перенос тепловой энергии структурными частицами вещества (молекулами, атомами, ионами) в процессе их теплового движения. Такой теплообмен может происходить в любых телах с неоднородным распределением температур, но механизм переноса теплоты будет зависеть от агрегатного состояния вещества. Явление теплопроводности заключается в том, что кинетическая энергия атомов и молекул, которая определяет температуру тела, передаётся другому телу при их взаимодействии или передаётся из более нагретых областей тела к менее нагретым областям. Иногда теплопроводностью называется также количественная оценка способности конкретного вещества проводить тепло.
Численная характеристика теплопроводности материала равна количеству теплоты, проходящей через материал толщиной 1 м и площадью 1 кв.м за единицу времени (секунду) при разности температур на двух противоположных поверхностях в 1 К. Данная численная характеристика используется для расчета теплопроводности для калибрования и охлаждения профильных изделий.
Исторически считалось, что передача тепловой энергии связана с перетеканием теплорода от одного тела к другому. Однако более поздние опыты, в частности, нагрев пушечных стволов при сверлении, опровергли реальность существования теплорода как самостоятельного вида материи. Соответственно, в настоящее время считается, что явление теплопроводности обусловлено стремлением занять состояние более близкое к термодинамическому равновесию, что выражается в выравнивании температуры.
Температуропроводность (коэффициент температуропроводности) — физическая величина, характеризующая скорость изменения (выравнивания) температуры вещества в неравновесных тепловых процессах. Численно равна отношению теплопроводности к объёмной теплоёмкости при постоянном давлении, в системе СИ измеряется в м²/с.
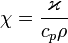 ,
,
где χ — температуропроводность, 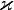 — теплопроводность, cp — изобарная удельная теплоёмкость, ρ — плотность
— теплопроводность, cp — изобарная удельная теплоёмкость, ρ — плотность
Температуропроводность и теплопроводность являются двумя из наиболее важных параметров веществ и материалов, поскольку они описывают процесс переноса теплоты и изменение температуры в них.
Величина коэффициента температуропроводности зависит от природы вещества. Жидкости и газы обладают сравнительно малой температуропроводностью. Металлы, напротив, имеют бо́льший коэффициент температуропроводности.
36) характеристика элементов подгруппы кислорода
В подгруппу кислорода входит пять элементов: кислород, сера, селен, теллур и полоний (радиоактивный металл). Это р-элементы VI группы периодической системы Д.И.Менделеева. Они имеют групповое название – халькогены, что означает «образующие руды»
У атомов халькогенов одинаковое строение внешнего энергетического уровня — ns2nр4. Этим объясняется сходство их химических свойств. Все халькогены в соединениях с водородом и металлами проявляют степень окисления -2, а в соединениях с кислородом и другими активными неметаллами — обычно +4 и +6. Для кислорода, как и для фтора, не типична степень окисления, равная номеру группы. Он проявляет степень окисления обычно -2 и в соединении со фтором +2. Такие значения степеней окисления следуют из электронного строения халькогенов
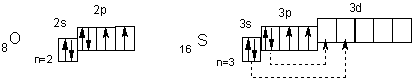
У атома кислорода на 2р-подуровне два неспаренных электрона. Его электроны не могут разъединяться, поскольку отсутствует d-подуровень на внешнем (втором) уровне, т. е. отсутствуют свободные орбитали. Поэтому валентность кислорода всегда равна двум, а степень окисления -2 и +2 (например, в Н2О и ОF2). Таковы же валентность и степени окисления у атома серы в невозбужденном состоянии. При переходе в возбужденное состояние (что имеет место при подводе энергии, например при нагревании) у атома серы сначала разъединяются Зр-, а затем 3s-электроны (показано стрелками). Число неспаренных электронов, а, следовательно, и валентность в первом случае равны четырем (например, в SO2), а во втором — шести (например, в SO3). Очевидно, четные валентности 2, 4, 6 свойственны аналогам серы — селену, теллуру и полонию, а их степени окисления могут быть равны -2, +2, +4 и +6.
Водородные соединения элементов подгруппы кислорода отвечают формуле Н2R (R - символ элемента): Н2О, Н2S, Н2Sе, Н2Те. Они называются хальководородами. При растворении их в воде образуются кислоты. Сила этих кислот возрастает с ростом порядкового номера элемента, что объясняется уменьшением энергии связи в ряду соединений Н2R. Вода, диссоциирующая на ионы Н+ и ОН-, является амфотерным электролитом.
Сера, селен и теллур образуют одинаковые формы соединений с кислородом типа RО2 и RО3-. Им соответствуют кислоты типа Н2RО3 и Н2RО4-. С ростом порядкового номера элемента сила этих кислот убывает. Все они проявляют окислительные свойства, а кислоты типа Н2RО3 также и восстановительные.
Закономерно изменяются свойства простых веществ: с увеличением заряда ядра ослабевают неметаллические и возрастают металлические свойства. Так, кислород и теллур — неметаллы, но последний обладает металлическим блеском и проводит электричество.
37) характеристика элементов подгруппы азота
Подгру́ппа азо́та, или пниктоге́ны [1] (пникти́ды) — химические элементы 15-й группы периодической таблицы химических элементов (по устаревшей классификации — элементы главной подгруппы V группы)[2]. В группу входят азот N, фосфор P, мышьяк As, сурьма Sb и висмут Bi[3]. Все элементы имеют электронную конфигурацию внешнего энергетического уровня атома ns²np³ и могут проявлять в соединениях степени окисления от −3 до +5[3]. Первые представители подгруппы — азот и фосфор — типичные неметаллы, мышьяк и сурьма проявляют металлические свойства, висмут — типичный металл. Таким образом, в данной группе резко изменяются свойства составляющих её элементов: от типичного неметалла до типичного металла. Химия этих элементов очень разнообразна и, учитывая различия в свойствах элементов, при изучении её разбивают на две подгруппы — подгруппу азота и подгруппу мышьяка.
Подгруппу азота составляют пять элементов: азот, фосфор, мышьяк, сурьма и висмут. Это р-элементы V группы периодической системы Д. И. Менделеева.
На наружном энергетическом уровне атомы этих элементов содержат пять электронов, которые имеют конфигурацию ns2np3 и распределены следующим образом:
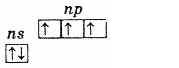
Поэтому высшая степень окисления этих элементов +5, низшая -3, характерна и +3.
Наличие трех неспаренных электронов на наружном уровне говорит о том, что в невозбужденном состоянии атомы элементов имеют валентность 3. Наружный уровень атома азота состоит только из двух подуровней — 2s и 2р. У атомов же остальных элементов этой подгруппы на наружных энергетических уровнях имеются вакантные ячейки d-подуровня. Следовательно, один из s-электронов наружного уровня может при возбуждении перейти на d-подуровень того же уровня, что приводит к образованию 5 неспаренных электронов.
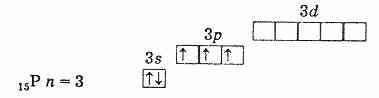
внешняя электронная оболочка фосфора (невозбужденный атом)
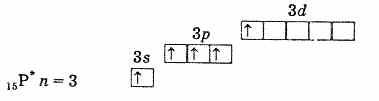
внешняя электронная оболочка возбужденного атома фосфора
Таким образом, фосфор, мышьяк, сурьма и висмут в возбужденном состоянии имеют 5 неспаренных электронов, и валентность их в этом состоянии равна 5.
В атоме азота возбудить электрон подобным образом нельзя вследствие отсутствия d-подуровня на втором уровне. Следовательно, пятивалентным азот быть не может, однако он может образовать четвертую ковалентную связь по донорно-акцепторному механизму за счет неподеленной электронной пары 2s2. Для атома азота возможен и другой процесс. При отрыве одного из двух 2s-электронов азот переходит в однозарядный четырехвалентный ион N+.

От азота к висмуту радиусы атомов увеличиваются, а ионизационные потенциалы уменьшаются. Восстановительные свойства нейтральных атомов усиливаются от N к Bi, а окислительные ослабевают (см. табл. 21).
С водородом азот, фосфор и мышьяк образуют полярные соединения RH3, проявляя отрицательную степень окисления -3. Молекулы RH3 имеют пирамидальную форму. В этих соединениях связи элементов с водородом более прочные, чем в соответствующих соединениях элементов подгруппы кислорода и особенно подгруппы галогенов. Поэтому водородные соединения элементов подгруппы азота в водных растворах не образуют ионов водорода.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 593; Нарушение авторских прав?; Мы поможем в написании вашей работы!