
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Практическая часть. Метод кислотно-основного титрования (определение, основное уравнение)
|
|
|
|
Учебная карта темы.
Метод кислотно-основного титрования (определение, основное уравнение).
Титриметрический метод анализа (понятие и виды).
Растворы (определение, классификация).
Основные правила техники безопасности при работе в химической лаборатории и правила ведения лабораторного журнала.
2.1.Механизм процессов растворения. Термодинамический подход к процессу растворения.
2.2. Растворимость газов в жидкостях. Закон Генри-Дальтона. Растворимость газов в крови. Кессонная болезнь.
2.3. Способы выражения концентрации растворов (массовая, мольная и объемная доли растворенного вещества, молярная концентрация, молярная концентрация эквивалента, титр раствора).
2.4. Взаимосвязь разных способов выражения концентрации растворов.
3.1.Расчеты в титриметрии. Закон эквивалентов.
3.2.Оборудование титриметрического анализа: мерные и вспомогательные менее точные посуды. Техника работы в объемном анализе (наблюдение за правильностью установки мениска при работе с пипеткой, мерной колбой и бюреткой, правила наливание раствора пипеткой, проверка емкости мерной посуды).
4.1. Ацидиметрия и алкалиметрия: исходные вещества и рабочие тированные растворы; кривые титрования, скачок титрования, точка эквивалентности; индикаторы и интервалы их перехода: метилоранж, фенолфталеин, принцип выбора индикаторов для титрования.
4.2. Применение реакции нейтрализации в фармакотерапии: лекарственные средства с кислотными и основными свойствами.
1. Практическая часть:
1.1. Примеры решение ситуационных задач.
1.2. Вопросы и ситуационные задачи для закрепления материала.
1.3. Контрольные вопросы.
2. Экспериментальная часть (лабораторная работа).
3. Контроль усвоения темы (тесты текущего уровня).
1.1.Ситуационные задачи (№№ с 1 по 7) с алгоритмами их решений, эталонами ответов и с комментариями
Расчет по массовой доле веществ в растворе
Задача №1. В медицине издавна борную кислоту / 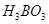 / (сассолин) применяют в виде 2-3% растворов для полоскания горла, в мазях и присыпках, т.к. она обладает антисептическими свойствами. Но, в настоящее время в связи с выявленными побочными явлениями внесены ограничения к ее применению. Сколько граммов
/ (сассолин) применяют в виде 2-3% растворов для полоскания горла, в мазях и присыпках, т.к. она обладает антисептическими свойствами. Но, в настоящее время в связи с выявленными побочными явлениями внесены ограничения к ее применению. Сколько граммов 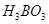 и воды нужно для приготовления 250 г раствора с массовой долей борной кислоты 3%?
и воды нужно для приготовления 250 г раствора с массовой долей борной кислоты 3%?
Решение.
1. Из формулы расчета массовой доли: 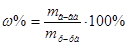 следует:
следует: 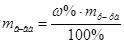
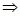
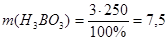 г.
г.
2. Чтобы рассчитать массу воды, нужно из общей массы раствора вычесть массу растворенного вещества: 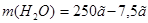 =242,5 г.
=242,5 г.
Ответ. 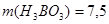 г.,
г., 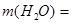 242,5 г.
242,5 г.
Расчеты при разбавлении и смешивании растворов с различной массовой долей растворенного вещества
Задача №2. Натрия нитрит / 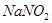 / в весьма редких случаях применяют внутрь при отравлении цианидами. В этом случае его вводят внутривенно в виде 1-2 % раствора. Какую массу воды следует добавить к 50 г раствора
/ в весьма редких случаях применяют внутрь при отравлении цианидами. В этом случае его вводят внутривенно в виде 1-2 % раствора. Какую массу воды следует добавить к 50 г раствора 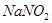 с массовой долей 11%, чтобы получить раствор с массовой долей 1% (0,01)?
с массовой долей 11%, чтобы получить раствор с массовой долей 1% (0,01)?
Решение.
1. Для расчета массы 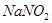 в исходном растворе воспользуемся формулой для расчета массовой доли:
в исходном растворе воспользуемся формулой для расчета массовой доли: 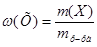 , преобразованной относительно m(X):
, преобразованной относительно m(X): 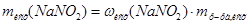 =
= 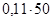 г = 5,5 г.
г = 5,5 г.
2. Найдем массу раствора, которую нужно получить. При добавлении воды масса растворенного вещества не изменяется, следовательно, масса нового раствора в соответствии с вышеуказанной формулой, преобразованной относительно 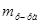 , имеет вид:
, имеет вид: 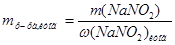 =
= 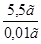 =550 г.
=550 г.
3. 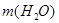 , которую следует добавить, равна разности между массой приготовленного раствора и массой исходного раствора:
, которую следует добавить, равна разности между массой приготовленного раствора и массой исходного раствора: 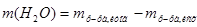 =
= 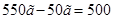 г.
г.
Ответ. 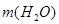 =500 г.
=500 г.
Расчет по молярной концентрации раствора
Задача №3. В медицине калия хлорид / 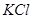 / применяется при нарушении сердечного ритма, особенно в связи с интоксикацией сердечными гликозидами, когда происходит обеднение клеток миокарда ионами K+. Сколько граммов
/ применяется при нарушении сердечного ритма, особенно в связи с интоксикацией сердечными гликозидами, когда происходит обеднение клеток миокарда ионами K+. Сколько граммов 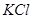 необходимо для приготовления 1 л раствора с
необходимо для приготовления 1 л раствора с 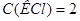 моль/л? Опишите процесс приготовления этого раствора (см. рисунок 2.1).
моль/л? Опишите процесс приготовления этого раствора (см. рисунок 2.1).
Решение.
1. Из формулы расчета молярной концентрации: 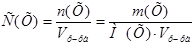 следует:
следует: 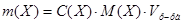
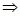
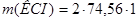 = 149,12 г.
= 149,12 г.
Ответ. 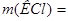 149,12 г.
149,12 г.
2. Приготовление растворов заданной концентрации


Расчет по молярной концентрации эквивалента
Задача №4. Перманганат калия / 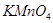 / применяют в медицинской практике как антисептическое средство наружно в водных растворах для промывания ран, полоскания полости рта и горла, а также для смазываний язвенных и ожоговых поверхностей. Рассчитайте сколько граммов
/ применяют в медицинской практике как антисептическое средство наружно в водных растворах для промывания ран, полоскания полости рта и горла, а также для смазываний язвенных и ожоговых поверхностей. Рассчитайте сколько граммов 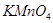 необходимо взять для приготовления 2 л раствора с С(
необходимо взять для приготовления 2 л раствора с С(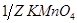 )= 0,5 моль/л, если анализ будет проводиться в кислой среде?
)= 0,5 моль/л, если анализ будет проводиться в кислой среде?
Эталон решение.
1. Из формулы расчета молярной концентрации эквивалентов: 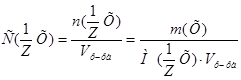 вытекает:
вытекает: 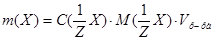 .
.
2. Таким образом, 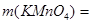
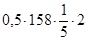 =6,53 г.
=6,53 г.
Ответ. 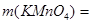 6,53 г.
6,53 г.
Связь между разными способами выражения концентрации
Задача №5. Вычислите молярную, эквивалентную молярную и моляльность раствора серной кислоты с 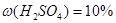 и
и 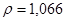
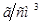 .
.
Решение.
1. Из формулы перехода от концентрации, выраженной массовыми долями растворенного вещества: 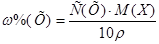 , к молярной концентрации вещества или молярной концентрации эквивалента вещества соответственно вытекает:
, к молярной концентрации вещества или молярной концентрации эквивалента вещества соответственно вытекает: 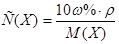 или
или 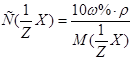 .
.
2. Согласно вышеуказанным формулам получаем: 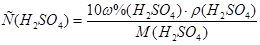 =
= 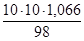 =
= 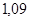 моль/л;
моль/л; 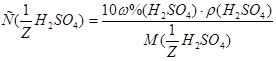 . С учетом того, что
. С учетом того, что 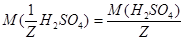 =
= 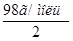 = 49 г/моль, получаем:
= 49 г/моль, получаем: 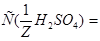
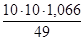 = 2,18 моль/л. Как видно, для перехода от молярной концентрации вещества к молярной концентрации его эквивалента надо знать только значение фактора эквивалентности
= 2,18 моль/л. Как видно, для перехода от молярной концентрации вещества к молярной концентрации его эквивалента надо знать только значение фактора эквивалентности 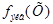 , которое показывает, во сколько раз молярная концентрация эквивалента вещества больше молярной концентрации вещества.
, которое показывает, во сколько раз молярная концентрация эквивалента вещества больше молярной концентрации вещества.
3. Для определения моляльности раствора сначала найдем массу 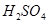 в воде массой 1 кг:10:90=х:1000;
в воде массой 1 кг:10:90=х:1000; 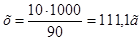 . Отсюда
. Отсюда 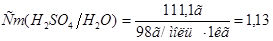 моль/кг.
моль/кг.
Ответ. 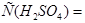
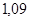 моль/л;
моль/л; 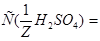 2,18
2,18 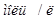 ;
; 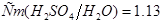 моль/кг.
моль/кг.
Расчет для приготовления растворов лекарственных препаратов при введении больному
Задача №6. Больному при угнетении дыхания и кровообращения различного происхождения необходимо ввести 100 мг лекарственное средство 4-этил-4-метил-2,6-пиперидиндион (бемегрида). Сколько мл этого раствора с массовой долей 0,5% необходимо ввести больному?
Эталон решение.
1. Исходные данные: 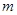 (бемегрида)= 100 мг= 0,1 г., ρ=1 г/мл.
(бемегрида)= 100 мг= 0,1 г., ρ=1 г/мл.
2. Из формул: 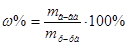 ,
, 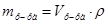 ,
, 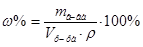 , следует:
, следует: 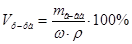 =
= 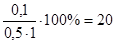 мл (или 20 см3).
мл (или 20 см3).
Ответ. Больному надо ввести 20 мл бемегрида.
Вычисления по результатам прямого титрования
Задача №7. В медицине кислоту хлористоводородную разведенную применяют внутрь в каплях или в виде микстуры (чаще вместе с пепсином) при недостаточной кислотности желудочного сока и ее обычно назначают совместно с препаратами железа, так как она способствует улучшению их всасывания. Какова молярная концентрация эквивалента и титр хлороводородной кислоты, если на нейтрализацию 20 мл ее раствора по реакции 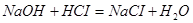 израсходовано 30 мл раствора гидроксида натрия С
израсходовано 30 мл раствора гидроксида натрия С 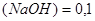 моль/л
моль/л
Эталон решение.
1. Из формулы закона эквивалентов: 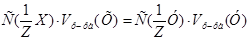 , следует:
, следует: 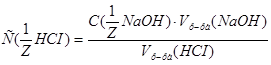 =
= 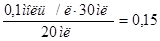 моль/л.
моль/л.
2. Определяем титр раствора HCI по формуле: 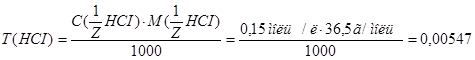 г/мл.
г/мл.
Ответ. 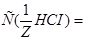 0,15 моль/л;
0,15 моль/л; 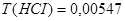 г/мл.
г/мл.
1.2. Ситуационные задачи (№№ с 8 по 16) для закрепления материала (выполнить в протокольной тетради).
Задача №8. Больному массой 59 кг необходимо ввести раствор NaHCO3 из расчета 0,66 ммоль/кг. Сколько мл раствора с массовой долей 4,2% необходимо взять?
Задача №9. Для лечения гнойных ран, а также для полосканий и смазываний при воспалительных заболеваниях слизистых оболочек (стоматиты, ангина) фармацевтом был приготовлен раствор из 5 мл 30% раствора Н2О2 и 15 мл дистиллированной воды. Рассчитайте массовую долю Н2О2 в полученном растворе (ρ=1 г/мл).
Задача №10. Фармакопейным препаратом перекиси водорода является раствор перекиси водорода, содержащий 2,7-3,3 % Н2О2 и этот препарат готовят из более концентрированного раствора, содержащего 27,5-31,0% Н2О2 называемого пергидролем. Рассчитайте массу Н2О2 и объем воды, необходимые для приготовления 100 г 3% раствора Н2О2.
Задача № 11. Сколько миллилитров 30% (ρ=1,15 г/мл) раствора соляной кислоты надо взять для приготовления 0,5 л 8,4% фармакопейного препарата HCI (ρ=1,041 г/мл)?
Задача №12. Раствор Люголя, применяющийся в ЛОР- практике для смазывания слизистой оболочки полости рта и горла, содержит 17 мл воды, 1 г йода, 2 г йодида калия. Рассчитать массовые и молярные доли йода и йодида калия в растворе Люголя.
Задача №13. Какую массу глюкозы необходимо растворить в воде массой 260 г, чтобы получить раствор, моляльность которого Сm (С6H12O6/H2O)= 0,5 моль/кг?
Задача №14. Растворы 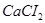 в медицинской практике применяют как противоядие при отравлениях: солями магния, щавелевой кислотой и ее растворимыми солями, а также растворимыми солями фтористой кислоты, т.к. при этом образуются недиссоцирующие и нетоксичные соединения: оксалат и фторид кальция. Сколько граммов 10% раствора хлорида кальция /
в медицинской практике применяют как противоядие при отравлениях: солями магния, щавелевой кислотой и ее растворимыми солями, а также растворимыми солями фтористой кислоты, т.к. при этом образуются недиссоцирующие и нетоксичные соединения: оксалат и фторид кальция. Сколько граммов 10% раствора хлорида кальция / 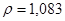
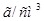 / потребуется для приготовления 20 мл 2% раствора /
/ потребуется для приготовления 20 мл 2% раствора / 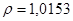
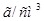 /. Рассчитать молярную долю, молярную, эквивалентную молярную концентрацию и титр полученного раствора.
/. Рассчитать молярную долю, молярную, эквивалентную молярную концентрацию и титр полученного раствора.
Задача №15. Для стандартизации раствора хлороводородной кислоты навеску буры (Na2B4O7∙10H2O) массой 0,256 г растворили в мерной колбе объемом 100 мл. На титрование затрачено 13,16 мл раствора HCl. Вычислите молярную концентрацию эквивалента раствора хлороводородной кислоты.
|
|
|
|
|
Дата добавления: 2015-03-29; Просмотров: 1727; Нарушение авторских прав?; Мы поможем в написании вашей работы!