
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Суть, методы и индикаторы метода кислотно-основного титрования
|
|
|
|
Суть. В основе метода кислотно-основного титрования положена реакция взаимодействия ионов водорода  или гидроксония
или гидроксония  с гидроксид- ионами
с гидроксид- ионами 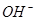 , сопровождающаяся образованием слабодиссоциированных молекул воды (растворителя).
, сопровождающаяся образованием слабодиссоциированных молекул воды (растворителя).
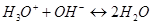 (или упрощенно
(или упрощенно  ).
).
Согласно протолитической теории кислот и оснований, эту реакцию в общем виде можно представить следующим уравнением:
 , в котором
, в котором 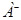 и
и 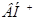 - соответственно основание и кислота, сопряженные исходным.
- соответственно основание и кислота, сопряженные исходным.
Этим методом проводят определение кислот, оснований, гидролизующихся солей, азота, серы в органических соединениях. В качестве титрантов обычно используют сильные кислоты и основания, так как реакции с их участием протекают более полно, чем с участием их слабых аналогов.
Прямое титрование в водных растворах возможно в случае определения сильных кислот, щелочей и тех слабых электролитов, константы, ионизации которых не слишком малы: 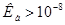 или
или 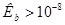 . Прямое титрование гидролизующихся солей возможно, если они образованы достаточно слабыми кислотами или основаниями:
. Прямое титрование гидролизующихся солей возможно, если они образованы достаточно слабыми кислотами или основаниями:  или
или  .
.
На кривых титрования многоосновных кислот и оснований может быть несколько скачков (точек эквивалентности). Титрование таких электролитов по стадиям возможно, если отношение констант ионизации  .
.
Методы. В зависимости от титранта различают методы ацидиметрического (acidum — кислота - определение оснований) и алкалиметрического (alcalis -щелочь – определение кислот) титрования.
В качестве рабочих растворов используют чаще всего растворы кислот хлороводородной и серной, растворы гидроксидов натрия и калия. Поскольку эти кислоты и- гидроксиды не могут быть использованы как исходные вещества для приготовления титрованных растворов, то сначала готовят растворы примерной концентрации, а точный титр и молярную концентрацию эквивалента их устанавливают по исходным веществам, Чаще всего применяют 0,1—0,05 М растворы.
В качестве первичного стандарта для определения концентрации кислот используют тетраборат натрия или карбонат натрия безводный, а для определения концентрации растворов щелочей — щавелевую 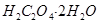 или янтарную
или янтарную 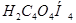 кислоту. Все эти вещества весьма удобны для работы и дают хорошие результаты при титровании.
кислоту. Все эти вещества весьма удобны для работы и дают хорошие результаты при титровании.
Индикаторы. Конечную точку титрования устанавливают с помощью кислотно-основных индикаторов. Кислотно-основные индикаторы - это органические красители, обладающие свойствами слабых кислот или оснований, причем их кислотные и основные формы различаются по окраске.
Для определения конечной точки титрования подбирают такой индикатор, у которого величина рТ (показатель титрования) совпадает со значением рН титруемого раствора в точке эквивалентности или находится внутри интервала резкого изменения рН, рассчитанного с допустимой погрешностью титрования.
Оборудование: пипетки Мора и градуированные вместимостью 5 или 10 мл, резиновые груши, бюретки вместимостью 25 мл на штативе; воронки; мерные колбы на 100 мл, конические колбы вместимостью 250 мл, мензурки, цилиндры, электрическая плитка.
Реактивы: раствор первичного стандарта – 0,1 моль /л дигидрат щавелевой кислоты, раствор титранта – гидроксид натрия (приблизительная концентрация 0,1 моль/л), соляная кислота с ρ=1,04 г/мл; индикаторы – растворы фенолфталеина и метилоранжа; дистиллированная вода.
Опыт №1.Установление точной концентрации рабочего раствора NaOH
Цель работы. Научиться стандартизировать титранты по первичному стандарту с применением прямого титрования, а именно: получить навыки работы пипетками Мора, бюретками и выполнения титрования; научиться выбирать индикаторы для конкретных случаев кислотно-основного титрования; научиться выполнять расчеты по результатам титрования.
Принцип метода. В основе метода лежит кислотно-основное титрование и закон эквивалентов: все вещества реагируют друг с другом в строгих весовых соотношениях, пропорциональных их молярным массам эквивалентов:
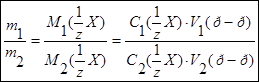
Стандартизацию растворов щелочи проводят по дигидрату щавелевой кислоты 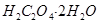 ; титруют в присутствии фенолфталеина, т.к. среда в точке эквивалентности слабощелочная:
; титруют в присутствии фенолфталеина, т.к. среда в точке эквивалентности слабощелочная:  . Фактор эквивалентности щавелевой кислоты равен
. Фактор эквивалентности щавелевой кислоты равен 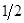 , эквивалентом является половина молекулы щавелевой кислоты, молярная масса эквивалента равна половине молярной массы щавелевой кислоты. Для гидроксида натрия фактор эквивалентности равен 1.
, эквивалентом является половина молекулы щавелевой кислоты, молярная масса эквивалента равна половине молярной массы щавелевой кислоты. Для гидроксида натрия фактор эквивалентности равен 1.
Ход работы:
1. Бюретку промойте рабочим раствором NaOH и доведите уровень раствора в ней до «0» (правила мениска).
2. 5 мл раствора дигидрат щавелевой кислоты с 0,1 моль/л переносите в коническую колбу для титрования, прибавьте 2-3 капли индикатора фенолфталеина и нагревайте на электрической плитке до кипения (до 50-60оС).
3. Горячий раствор титруйте рабочим раствором NaOH, прибавляя его из бюретки по каплям до появления неисчезающей в течение 30 с бледно-розовой окраски раствора. В точке эквивалента определите по шкале объем раствора 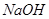 –
– 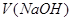 .
.
4. Титрование повторите до тех пор, пока не будут получены 3 сходящихся (т.е. отличающихся друг от друга не более чем на 0,1 мл) результата. По окончании титрования бюретку закрывайте пробкой, чтобы раствор щелочи не поглощал углекислый газ из воздуха.
5. Из 3 сходящихся результатов титрования рассчитывайте точную молярную концентрацию эквивалента раствора 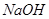 по формуле:
по формуле: 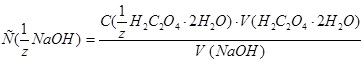 .
.
6. Все вышеуказанные данные и результаты расчетов занесите в таблицу №2.1.
Таблица 2.1
|
|
|
|
|
Дата добавления: 2015-03-29; Просмотров: 890; Нарушение авторских прав?; Мы поможем в написании вашей работы!