
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методы определения С-концевой аминокислоты
|
|
|
|
Ферментативные методы. Обработка полипептида карбоксипептидазой приводит к освобождению С-концевой аминокислоты, которуюустанавливают методом хроматографии.
Химический метод Акабори. Гидразин, вызывая распад пептидных связей, реагирует со всеми аминокислотами, за исключением С-концевой.
Следующий этап - определение последовательности аминокислот в полипептидной цепи. Проводят частичный гидролиз полипептидной цепи на короткие пептидные фрагменты. Избирательно гидролизующие вещества: цианогенбромид CNBr (по остаткам мет), гидроксиламин (по связям между остатками асп и гли), N-бромсукцинамид (по остаткам три). Пепсин ускоряет гидролиз связей, образованных остатками фен, тир и глу, трипсин - арг и лиз, химотрипсин - три, тир и фен.
Возможно применение рентгеноструктурного анализа, а также данных о комплементарной нуклеотидной последовательности ДНК.
Вторичная структура белка – конфигурация полипептидной цепи, т.е. способ упаковки полипептидной цепи в определенную конформацию
(рис. 1). Процесс этот протекает не хаотично, а в соответствии с первичной структурой белка.
 а
а
|  б
б
|
| Рис. 1. Вторичная структура белка: а - a-спираль, б - b-структура |
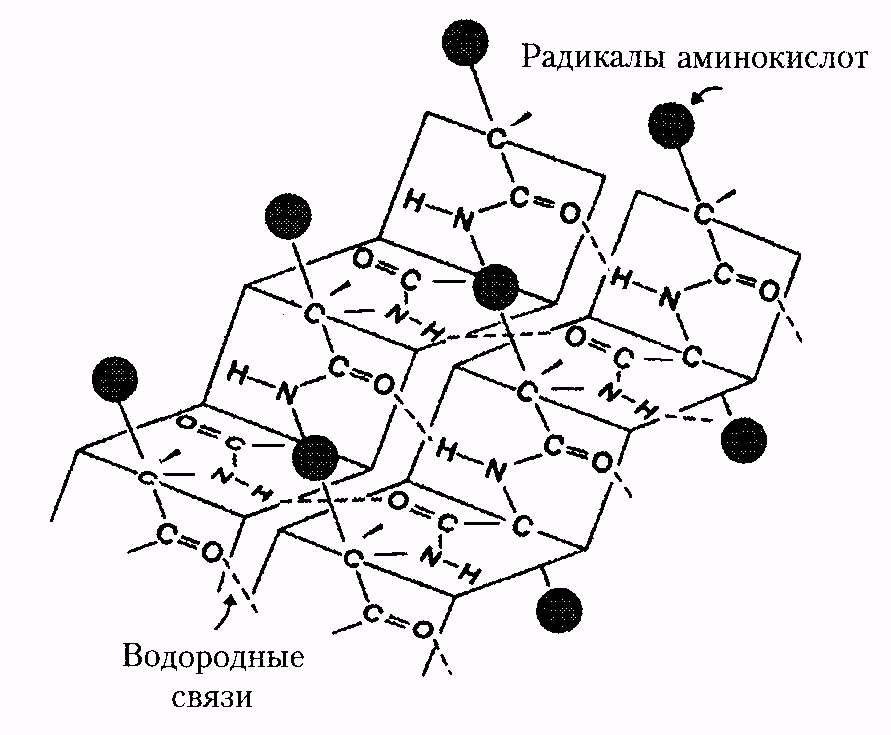
Стабильность вторичной структуры обеспечивается в основном водородными связями, однако определенный вклад вносят ковалентные связи – пептидные и дисульфидные.
Наиболее вероятным типом строения глобулярных белков считают
a-спираль. Закручивание полипептидной цепи происходит по часовой стрелке. Для каждого белка характерна определенная степень спирализации. Если цепи гемоглобина спирализованы на 75%, то пепсина - всего на 30%.
Тип конфигурации полипептидных цепей, обнаруженных в белках волос, шелка, мышц, получил название b-структуры. Сегменты пептидной цепи располагаются в один слой, образуя фигуру, подобную листу, сложенному в гармошку. Слой может быть образован двумя или большим количеством пептидных цепей.
Способность к образованию водородных связей, являющихся движущей силой при возникновении α- и β-структур в белковой молекуле, присуща разным аминокислотам в неодинаковой степени. Выделяют группу спиралеобразующих аминокислот: ала, глу, глн, лей, лиз, мет и гис. Вал, иле, тре, тир и фен способствуют образованию b-слоев полипептидной цепи. Гли, сер, асп, асн и про имеют отношение к преимущественному возникновению неупорядоченных фрагментов в ее составе.
В природе существуют белки, строение которых не соответствует ни
β-, ни a-структуре (коллаген).
Третичная структура белка – пространственная ориентация полипептидной спирали или способ укладки полипептидной цепи в определенном объеме. Первый белок, третичная структура которого была выяснена рентгеноструктурным анализом - миоглобин кашалота (рис. 2).
В стабилизации пространственной структуры белков, помимо ковалентных связей, основную роль играют нековалентные связи (водородные, электростатические взаимодействия заряженных групп, межмолекулярные ван-дер-ваальсовы силы, гидрофобные взаимодействия и т.д.).
Методами рентгеноструктурного анализа доказано существование уровней структурной организации белковой молекулы, промежуточных между вторичной и третичной структурами. Домен - это компактная глобулярная структурная единица внутри полипептидной цепи (рис. 3). Открыто много белков (в частности, иммуноглобулины), состоящих из разных по структуре и функциям доменов, кодируемых разными генами.

| 
|
| Рис. 2. Третичная структура миоглобина | Рис. 3. Глобулярные домены в g-кристаллине (белке хрусталика глаза человека) |
По современным представлениям, третичная структура белка после завершения его синтеза формируется самопроизвольно. Основной движущей силой является взаимодействие радикалов аминокислот с молекулами воды. При этом неполярные гидрофобные радикалы аминокислот погружаются внутрь белковой молекулы, а полярные радикалы ориентируются в сторону воды.
Процесс формирования нативной пространственной структуры полипептидной цепи - фолдинг. Из клеток выделены белки, названные шаперонами. Они участвуют в фолдинге (рис. 4). Описан ряд наследственных заболеваний человека, развитие которых связывают с нарушением вследствие мутаций процесса фолдинга (пигментозы, фиброзы и др.).
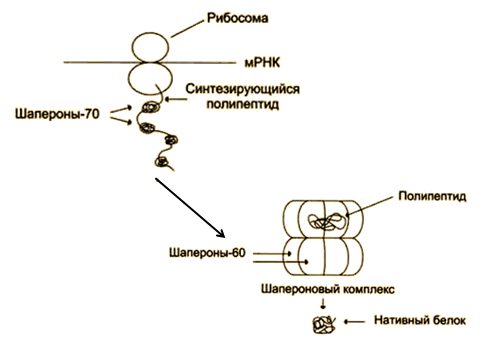
Рис. 4. Участие шаперонов в фолдинге белков
Все биологические свойства белков связаны с сохранностью их третичной структуры, называемой нативной. Белковая глобула не является абсолютно жесткой: возможны обратимые перемещения частей полипептидной цепи. Эти изменения не нарушают общей конформации молекулы. На конформацию молекулы белка оказывают влияние рН среды, ионная сила раствора, взаимодействие с другими веществами. Любые воздействия, приводящие к нарушению нативной структуры молекулы, сопровождаются частичной или полной потерей белком его биологических свойств.
Четвертичная структура белка - укладка отдельных полипептидных цепей, обладающих первичной, вторичной или третичной структурой, в пространстве, и формирование единого макромолекулярного образования.
Белковую молекулу, состоящую из нескольких полипептидных цепей, называют олигомером, а каждую входящую в него цепь - протомером. Олигомерные белки чаще построены из четного числа протомеров, например, молекула гемоглобина состоит из двух a- и двух b-полипептидных цепей (рис. 5).
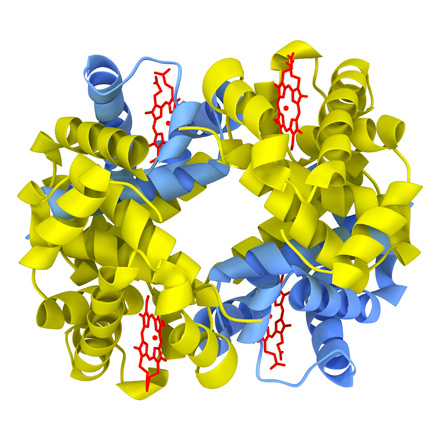
|
| Рис. 5. Молекула гемоглобина |
Четвертичной структурой обладает около 5% белков, в том числе гемоглобин, иммуноглобулины. Субъединичное строение свойственно многим ферментам, в первую очередь тем, которые выполняют сложные функции. Почти все ДНК- и РНК-полимеразы имеют четвертичную структуру. Белковые молекулы, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности и лишь после окончания синтеза формируют общую надмолекулярную структуру. Биологическую активность белок приобретает только при объединении входящих в его состав протомеров. В стабилизации четвертичной структуры принимают участие те же типы взаимодействий, что и в стабилизации третичной.
Некоторые исследователи признают существование пятого уровня структурной организации белков. Это метаболоны -полифункциональные макромолекулярные комплексы разных ферментов, катализирующих весь путь превращений субстрата (синтетазы высших жирных кислот, пируватдегидрогеназный комплекс, дыхательная цепь).
Белок, выполняющий определенную функцию в живой клетке, может быть представлен несколькими формами - изофункциональными белками, или изобелками. Так, в эритроцитах человека обнаружено несколько форм гемоглобина: HbF характерен для эмбриональной стадии развития человека (фетальный гемоглобин), у взрослого человека преобладают НbА. Все формы гемоглобинов выполняют функцию переноса кислорода из легких в ткани, однако свойства разных гемоглобинов отличаются.
|
|
|
|
|
Дата добавления: 2015-03-31; Просмотров: 1664; Нарушение авторских прав?; Мы поможем в написании вашей работы!