
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическая природа ферментов
|
|
|
|
ФЕРМЕНТЫ
Ферменты или энзимы - вещества преимущественно белковой природы, обладающие каталитической активностью. Первоначально считали, что все ферменты являются белками. В начале 80-х годов XX в. были открыты низкомолекулярные рибонуклеиновые кислоты (рибозимы), спопобные выполнять каталитическую функцию. Термин «энзим» происходит от греч. en zyme - в дрожжах, «фермент» - от лат. fermentatio - брожение.
Энзимология – наука о ферментах.
Хотя уже осуществлен лабораторный синтез ряда ферментов (рибонуклеазы, лизоцима), единственный способ получения ферментов - из биологических объектов. Для выделения ферментов из клеточного содержимого необходимо тонкое измельчение, вплоть до разрушения субклеточных структур. Все операции проводят в условиях, исключающих денатурацию белка (использование защитных добавок, низкая температура).
Содержание ферментов в различных субклеточных структурах неодинаково, так, например, ферменты гликолиза сосредоточены преимущественно в цитоплазме, ферменты цикла Кребса - в митохондриях.
Доказательства белковой природы ферментов:
1. Ферменты при гидролизе распадаются на аминокислоты.
2. Под действием кипячения и других факторов ферменты подвергаются денатурации и теряют каталитическую активность.
3. Осуществлено выделение ферментов в форме кристаллов белка.
4. Ферменты оказывают высокоспецифическое действие.
Прямым доказательством белковой природы ферментов является лабораторный синтез рибонуклеазы.
Выделяют простые ферменты, состоящие только из полипептидной цепи: пепсин, трипсин, уреаза, рибонуклеаза, фосфатаза и др.
Большинство природных ферментов - сложные белки. Их небелковые компоненты называются кофакторами; они необходимы для выполнения ферментом его каталитической роли. Кофакторами ферментов являются витамины или соединения, построенные с их участием (коэнзим А, НАД+, ФАД), фосфорные эфиры некоторых моносахаридов, ионы металов.
Кофермент - небелковый фактор, который легко отделяется от белковой части - апофермента -при диссоциации.
Простетическая группа – ковалентно связанный с белковой цепью небелковый компонент, который не отделяется при выделении и очистке фермента.
Апофермент – белковая часть фермента. В апоферменте есть участок, избирательно связывающий кофермент. Это кофермент связывающий домен. Его структура у различных апоферментов, соединяющихся с одним и тем же коферментом, сходна.
Весь фермент вместе с простетической группой называют холоферментом. Только объединение апофермента и кофермента обеспечивает активность холофермента.
Субстрат – вещество, подвергающееся превращениям под действием фермента.
Активный центр - специфический участок на поверхности фермента, связывающийся с молекулой субстрата и непосредственно участвующий в катализе. Активный центр у ферментов обычно располагается на дне щели или глубокой впадины (например, у трипсина). Активные центры ферментов образуются на уровне третичной структуры. У сложных ферментов в состав активного центра входят также простетические группы. Кофакторы ферментов выполняют функцию промежуточных переносчиков атомов или групп.
В активном центре различают два участка. Субстратный (связывающий) центр - участок, отвечающий за присоединение субстрата. Его называют контактной, или «якорной» площадкой фермента. Каталитический центр отвечает за химическое превращение субстрата. В состав каталитического центра большинства ферментов входят серин, цистеин, гистидин, тирозин, лизин. Субстратный центр может совпадать (или перекрываться) с каталитическим центром.
Аллостерический центр - участок молекулы фермента вне его активного центра, который способен связываться с тем или иным веществом (лигандом). В результате изменяется третичная, а часто и четвертичная структура белковой молекулы. Как следствие претерпевают изменения конфигурация активного центра и каталитическая активность фермента. Это аллостерическая регуляция активности ферментов. Ферменты, активность каталитического центра которых меняется под влиянием аллостерических эффекторов, называют аллостерическими.
Некоторые из ферментов являются полифункциональными, т. е. обладают несколькими энзиматическими активностями, но всего лишь одной полипептидной цепью. Их белковая цепь образует несколько доменов, каждый из которых характеризуется своей каталитической активностью (алкогольдегидрогеназа не только катализирует реакцию окисления спиртов, но также реакции обезвреживания ряда ксенобиотиков).
Изоферменты - это множественные формы фермента, катализирующие одну и ту же реакцию, но отличающиеся друг от друга по физическим и химическим свойствам: сродству к субстрату, активности, электрофоретической подвижности. Например, фермент лактатдегидрогеназа (ЛДГ) катализирует обратимое превращение пировиноградной кислоты в молочную. ЛДГ состоит из 4 субъединиц и содержит два типа полипептидных цепей: Н - сердечный тип (от англ. Heart - сердце) и М - мышечный тип (от англ. Muscle - мышца). Этот фермент благодаря различным сочетаниям субъединиц может существовать в 5 формах (рис. 14).
Для каждой ткани в норме характерно свое соотношение форм (изоферментный спектр) ЛДГ. В сердечной мышце преобладает Н4, т.е. ЛДГ1, а в скелетных мышцах и печени – М4 (ЛДГ5). Изучение появления изоферментов ЛДГ в сыворотке крови позволяет судить о месте патологического процесса и о степени поражения органа или ткани.
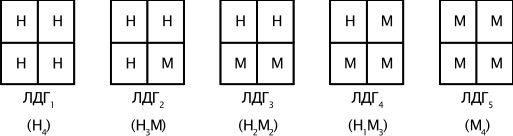
Рис. 14. Изоформы ЛДГ
Особую группу ферментов составляют мультимолекулярные ферментные комплексы. Существование таких комплексов ускоряет химические превращения. Если мультиэнзимный комплекс обслуживает единый, многоступенчатый процесс биохимических превращений, его называют метаболоном. Напимер, метаболоны гликолиза, цикла Кребса, дыхательная цепь митохондрий, НАДФН-оксидаза (рис. 15) и др.
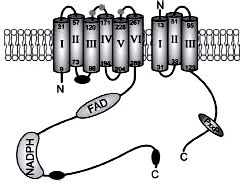
Рис. 15. НАДФН-оксидаза
|
|
|
|
|
Дата добавления: 2015-03-31; Просмотров: 728; Нарушение авторских прав?; Мы поможем в написании вашей работы!