
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ферменты в медицине
|
|
|
|
КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА ФЕРМЕНТОВ
Аллостерическая регуляция.
Химическая модификация фермента.
Регуляция активности ферментов путем фосфорилирования-дефосфорилирования. Протекает при участии протеинкиназ по ОН-группам серина и треонина, а в ряде случаев – тирозина. Активным ферментом может быть или фосфорилированная или дефосфорилированная форма. Фермент липаза активируется путем фосфорилирования.
Регуляция активности путем ассоциации-диссоциации субъединиц в олигомерном ферменте. Например, фермент протеинкиназа в неактивной форме является тетрамером. Для активации протеинкиназы необходима диссоциация субъединиц.
Активация ферментов путем частичного протеолиза. Некоторые ферменты синтезируются неактивными и лишь после секреции из клетки переходят в активную форму путем удаления части белковой молекулы. Так происходит активация протеолитических ферментов, в частности, трипсина.
Во многих случаях основным типом регуляции скорости многоступенчатого ферментативного процесса является ингибирование по принципу обратной связи. Конечный продукт подавляет активность фермента, катализирующего первую стадию синтеза, которая является ключевой для данной цепи реакции. Он связывается с аллостерическим центром молекулы фермента. Это ингибирование по принципу обратной связи, или ретроингибирование.
Современные классификация и номенклатура ферментов разработаны Комиссией по ферментам Международного биохимического союза и утверждены на V Международном биохимическом конгрессе в 1961 г. в г. Москве.
В основу классификации легли три принципа:
1. Химическая природа фермента.
2. Химическая природа субстрата, на который действует фермент.
3. Тип катализируемой реакции.
Ферменты делят на шесть классов.
| СООН СООН ½ ½ НО – С – Н малатдегидрогеназа С = О ½ + НАД+ ----------------------------à ½ + НАДН + Н+ Н – С – Н ß--------------------------- СН2 ½ ½ СООН СООН L – малат оксалоацетат |
Аэробные дегидрогеназы, или оксидазы, катализируют перенос протонов (электронов) непосредственно на кислород;
Анаэробные дегидрогеназы ускоряют перенос протонов (электронов) на промежуточный субстрат, но не на кислород.
Наиболее распространены оксидоредуктазы, содержащие в качестве кофактора никотинамидадениндинуклеотид ( НАД+), либо никотинамидадениндинуклеотидфосфат (НАДФ+). Их называют пиридинферментами.
Коферментами оксидоредуктаз являются также флавопротеины (ФП) – флавинмононуклеотид ( ФМН) и флавинадениндинуклеотид (ФАД). Подобные ферменты получили название флавиновых дегидрогеназ.
2. Трансферазы - ферменты, катализирующие реакции межмолекулярного переноса различных атомов, групп атомов и радикалов.
Фосфотрансферазы катализируютперенос остатка фосфорной кислоты. Донором фосфатных остатков в большинстве случаев является АТФ. Фосфорные эфиры органических соединений обладают повышенной химической активностью. Реакция фосфорилирования глюкозы катализируется гексокиназой или АТФ,D-глюкоза-6-фосфотрансеразой:
Протеинкиназы переносят остаток фосфата с АТФ на белки,изменяя их биологическую активность.
Аминотрансферазы ускоряют реакцию переноса аминогруппы с аминокислоты на a-кетокислоту:
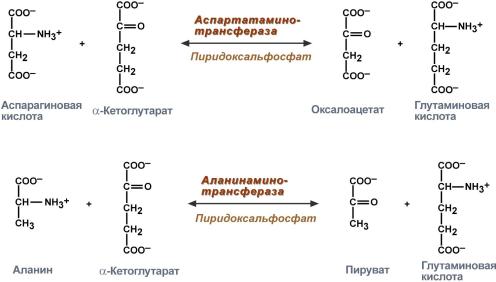
аспарагиновая α-кетоглутарат оксалоацетат глутаминовая
кислота кислота
Гликозилтрансферазы катализируют реакции переноса гликозильных остатков; ацилтрансферазы – реакции переноса ацилов (остатков карбоновых кислот).
3. Гидролазы катализируют расщепление внутримолекулярных связей органических веществ при участии молекулы воды.
| СН2 – О – СО – С15Н31 СН2 – ОН ½ липаза ½ СН – О – СО – С15Н31 + 2НОН ---------à СН – О – СО – С15Н31 + 2С15Н31СООН ½ ß-------- ½ пальмитиновая СН2 – О – СО – С15Н31 СН2 – ОН кислота трипальмитин b-пальмитилглицерин |
Фосфатазы гидролизуют фосфорные эфиры:
Г-1-Ф + Н2О 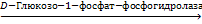 Г + Н3РО4
Г + Н3РО4
Гликозидазы катализируют гидролиз гликозидов. Амилаза расщепляет гликозидные связи в молекулах крахмала.
Пептидгидролазы ускоряют гидролиз пептидных связей в белках и пептидах.
4. Лиазы - ферменты, катализирующие разрыв связей С—О, С—С,
С—N и других, а также обратимые реакции отщепления различных групп от субстратов негидролитическим путем. Эти реакции, как правило, сопровождаются образованием двойной связи и выделением таких простейших продуктов, как СО2, H2O, NH3 и т. д..
Декарбоксилазы относятся к углерод-углерод-лиазам:

Некоторые лиазы ускоряют реакции не только отщепления, но и присоединения.
5. Изомеразы - ферменты, катализирующие взаимопревращения структурных, оптических и геометрических изомеров.
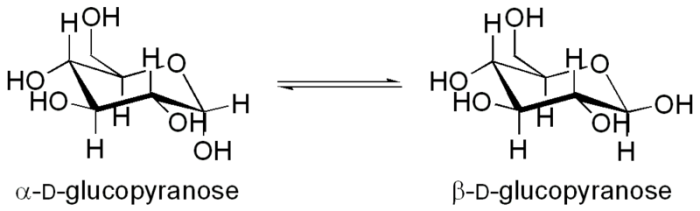
Мутаротаза ускоряет реакцию превращения α-D-глюкопиранозы в
β-D-глюкопиранозу:
6. Лигазы (синтетазы) - ферменты, катализирующие синтез органических веществ из двух исходных молекул с использованием энергии АТФ либо других веществ:
пируваткарбоксилаза
СН3-СО-СООН + СО2 + АТФ ----------------------------àНООС-СН2-СО-СООН + АДФ + Рi.
пировиноградная оксалоацетат
кислота
Международная комиссия подготовила Классификацию ферментов (КФ). Код каждого фермента содержит четыре цифры, разделенные точками. Первая цифра указывает номер класса, вторая означает подкласс и характеризует вид субстрата (у трансфераз указывает на природу переносимой группы, у гидролаз - на тип гидролизуемой связи). Третья цифра уточняет природу участвующих в реакции соединений или групп. Четвертая цифра – номер фермента в данном подподклассе. В подподклассе ферменты располагаются по алфавиту. Пример: пепсин – пептид-пептидогидролаза;
КФ 3.4.4.1.
Ферменты применяют как лечебные препараты (таблица 2):
- при их отсутствии или недостатке (наследственном или приобретенном);
- для специфического разрушения некоторых продуктов обмена.
Таблица 2. Использование ферментов как лечебных препаратов
| Фермент | Использование |
| Пепсин | Нарушение переваривания белков в желудке |
| Уреаза | Удаление мочевины из организма в аппаратах «искусственная почка» |
| Гиалуронидаза | Рассасывание рубцов |
| Стрептокиназа, урокиназа | Предотвращение тромбообразования при операциях |
Ферменты используют в клинике в качестве аналитических реактивов (таблица 3). Для анализа часто применяются иммобилизованные ферменты, которые искусственно связаны с нерастворимым в воде носителем, что повышает стабильность белковых катализаторов.
Таблица 3. Использование ферментов как аналитических реагентов
| Фермент | Использование |
| Глюкозооксидаза | Определение концентрации глюкозы в крови |
| Липаза | Определение концентрации триацилглицеридов в крови |
| Холестеролоксидаза | Определение холестерина в крови |
Анализ кинетики появления и исчезновения ферментов в сыворотке крови используется в диагностике.
Состав ферментов и их распределение в тканях у взрослого человека в основном постоянен и может измениться при болезнях. Почти все ферменты организма функционируют внутриклеточно. При повреждении тканей внутриклеточные ферменты появляются в сыворотке крови. При воспалительных процессах повышается проницаемость клеточных мембран и в сыворотку крови попадают цитоплазматические ферменты. Некроз ткани сопровождается разрушением всех клеточных структур, и в сыворотке могут быть обнаружены митохондриальные, ядерные и другие ферменты. Такие ферменты называют индикаторными.
Появление в плазме или сыворотке крови ряда тканевых ферментов в повышенных количествах характеризует функциональное состояние различных органов и их поражение (таблица 4).
Таблица 4. Использование ферментов в диагностике
| Заболевание | Фермент |
| Инфаркт миокарда | креатинкиназа, АсАТ, ЛДГ-1 |
| Вирусный гепатит | АлАТ, АсАТ, глутаматдегидрогеназа |
| Заболевания поджелудочной железы | a-амилаза |
| Заболевания печени | АлАТ, g-глутамилтрансфераза |
Энзимопатии (синоним ферментопатии) - общее название болезней, развивающихся вследствие отсутствия или снижения активности тех или иных ферментов. В силу взаимозависимости метаболических путей дефект одного фермента часто приводит к целому ряду нарушений в обмене веществ.
Выделяют наследственные и приобретенные энзимопатии.
1. Наследственные энзимопатии связаны с генетически обусловленной недостаточностью одного или нескольких ферментов. Известно более 150 наследственных ферментопатий, для которых установлена сущность генной мутации. Ферментативный дефект приводит к накоплению в организме продуктов обмена веществ, нарушающих функцию тех или иных органов, что обусловливает появление клинических признаков болезни. К энзимопатиям относятся фенилкетонурия, гликогенозы, хондродистрофия, гемофилия и т.д.
|
|
|
|
|
Дата добавления: 2015-03-31; Просмотров: 991; Нарушение авторских прав?; Мы поможем в написании вашей работы!