
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Физические свойства. Гомологический ряд алкенов
|
|
|
|
Гомологический ряд алкенов
Реакции разложения
Реакции перегруппировки (изомеризация)
Реакции отщепления (дегидрирование)
а) CnH2n+2 t˚С, Ni или Pd → CnH2n + H2
б) При нагревании до 1500 С происходит образование ацетилена и водорода:
2CH4 1500°С → C2H2 + 3H2
н- алкан AlCl3, t°С → изоалкан
4. Реакции горения (горят светлым не коптящим пламенем)
CnH2n+2 + O2 t°С → nCO2 + (n+1)H2O
Помните! Смесь метана с воздухом и кислородом взрывоопасна
V(CH4): V(O2) = 1: 2
V(CH4): V(воздуха) = 1: 10
а) Крекинг при температуре 700-1000°С разрываются (-С-С-) связи:
C10H22 t°С → C5H12 + C5H10
алкан алкен
б) Пиролиз при температуре 1000°С разрываются все связи,
продукты – С и Н2:
СH4 1000°С → C + 2H2
в) Конверсия метана с образованием синтез – газа (СО + Н2)
CH4 + H2O 800˚C, Ni → СО + 3Н2
Вопрос № 3. Непредельные углеводороды с одной двойной связью (алкены). Общая формула. Гомологический ряд. Номенклатура. Изомерия. Электронное и пространственное строение на примере молекулы этилена (тип гибридизации, образование σ- и π- связи)
Алкены, или олефины (от лат. olefiant - масло — старое название, но широко используемое в химической литературе. Поводом к такому названию послужилхлористый этилен, полученный в XVIII столетии, — жидкое маслянист вещество.) — алифатические непредельные углеводороды, в молекулах которых между углеродными атомами имеется одна двойная связь.
Алкены содержат в своей молекуле меньшее число водородных атомов, чем соответствующие им алканы (с тем же числом углеродных атомов), поэтому такие углеводороды называют непредельными или ненасыщенными.
Алкены образуют гомологический ряд с общей формулой CnH2n
| СnH2n алкен | Названия, суффикс ЕН, ИЛЕН |
| C2Н4 | этен, этилен |
| C3H6 | пропен |
| C4H8 | бутен |
| C5H10 | пентен |
| C6H12 | гексен |
Гомологи:
СH2=CH2 этен
СH2=CH-CH3 пропен
СH2=CH-CH2-CH3 бутен-1
СH2=CH-CH2-CH2-СН3 пентен-1
Этилен (этен) – бесцветный газ с очень слабым сладковатым запахом, немного легче воздуха, малорастворим в воде.
С2 – С4 (газы)
С5 – С17 (жидкости)
С18 – (твёрдые)
· Алкены не растворяются в воде, растворимы в органических растворителях (бензин, бензол и др.)
· Легче воды
· С увеличением Mr температуры плавления и кипения увеличиваются
3. Простейшим алкеном является этилен - C2H4
Структурная и электронная формулы этилена имеют вид:
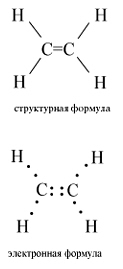
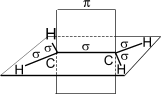
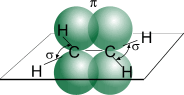
В молекуле этилена подвергаются гибридизации одна s - и две p -орбитали атомов C (sp 2-гибридизация).
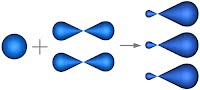
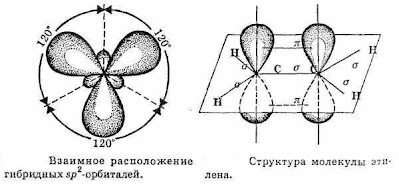
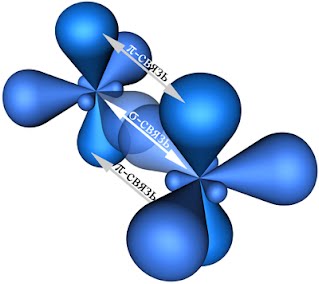
Таким образом, каждый атом C имеет по три гибридных орбитали и по одной негибридной p -орбитали. Две из гибридных орбиталей атомов C взаимно перекрываются и образуют между атомами C
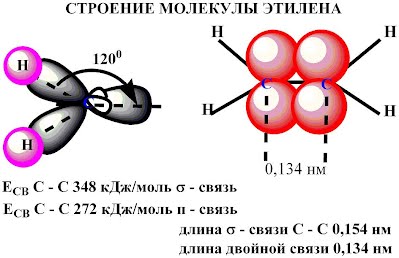
σ - связь. Остальные четыре гибридных орбитали атомов C перекрываются в той же плоскости с четырьмя s -орбиталями атомов H и также образуют четыре σ - связь. Две негибридные p -орбитали атомов C взаимно перекрываются в плоскости, которая расположена перпендикулярно плоскости σ - связь, т.е. образуется одна П - связь.
По своей природе П - связь резко отличается от σ - связь; П - связь менее прочная вследствие перекрывания электронных облаков вне плоскости молекулы. Под действием реагентов П - связь легко разрывается.
Молекула этилена симметрична; ядра всех атомов расположены в одной плоскости и валентные углы близки к 120°; расстояние между центрами атомов C равно 0,134 нм.
| Запомните! SP2 –гибридизация: 1) Плоское тригональное строение 2) Угол – HCH - 120° 3) Длина (-С=С-) связи – 0,134 нм 4) Связи - σ, П 5) Невозможно вращение относительно (-С=С-) связи |
Если атомы соединены двойной связью, то их вращение невозможно без того, чтобы электронные облака П - связь не разомкнулись.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 778; Нарушение авторских прав?; Мы поможем в написании вашей работы!