
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реакции замещения
|
|
|
|
Химические свойства алканов
Физические свойства
В обычных условиях
С1- С4 – газы
С5- С15 – жидкие
С16 – твёрдые
Температуры плавления и кипения алканов, их плотности увеличиваются в гомологическом ряду с ростом молекулярной массы. Все алканы легче воды, в ней не растворимы, однако растворимы в неполярных растворителях (например, в бензоле) и сами являются хорошими растворителями. Физические свойства некоторых алканов представлены в таблице.
Таблица. Физические свойства некоторых алканов
| Название | Формула | tпл °С | tкип °С |
| Метан | СН4 | -182,5 | -161,5 |
| Этан | С2Н6 | -182,8 | -88,6 |
| Пропан | С3Н8 | -187,7 | -42 |
| Бутан | С4Н10 | -138,3 | -0,5 |
| Пентан | C5H12 | -129,7 | +36,1 |
| Гексан | С6Н14 | -95,3 | 68,7 |
| Гептан | С7H16 | -90,6 | 98,4 |
| Октан | C8H18 | -56,8 | 124,7 |
| Нонан | С9Н20 | -53,7 | 150,8 |
| Декан | C10H22 | -29,6 | 174,0 |
| Пентадекан | C15H32 | +10 | 270,6 |
| Эйкозан | С20Н42 | 36,8 | 342,7 |
| Пентакозан | C25H52 | 53,7 |
а) Галогенирование
при действии света - hν или нагревании (стадийно – замещение атомов водорода на галоген носит последовательный цепной характер. Большой вклад в разработку цепных реакций внёс физик, академик, лауреат Нобелевской премии Н. Н. Семёнов)
В реакции образуются вещества галогеналканы R-Cl или Сn H2n+1 – Cl
CH4 + Cl2 hν → CH3Cl + HCl (1 стадия);
метан хлорметан
CH3Cl + Cl2 hν → CH2Cl2 + HCl (2 стадия);
дихлорметан
СH2Cl2 + Cl2 hν → CHCl3 + HCl (3 стадия);
трихлорметан
CHCl3 + Cl2 hν → CCl4 + HCl (4 стадия).
тетрахлорметан
Скорость реакции замещения водорода на атом галогена у галогеналканов выше, чем у соответствующего алкана, это связано с взаимным влиянием атомов в молекуле:
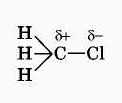
Электронная плотность связи С – Cl смещена к более электроотрицательному хлору, в результате на нём скапливается частичный отрицательный заряд, а на атоме углерода – частичный положительный заряд.
На атом углерода в метильной группе (- СН3) создаётся дефицит электронной плотности, поэтому он компенсирует свой заряд за счёт соседних атомов водорода, в результате связь С – Н становится менее прочной и атомы водорода легче замещаются на атомы хлора. При увеличении углеводородного радикала наиболее подвижными остаются атомы водорода у атома углерода ближайщего к заместителю:
CH3 – CH2 – Cl + Cl2 hν → CH3 – CHCl2 + HCl
хлорэтан 1,1 -дихлорэтан
Со фтором реакция идёт со взрывом.
С хлором и бромом требуется инициатор.
Иодирование происходит обратимо, поэтому требуется окислитель для удаления HI из рекции.
Внимание!
В реакциях замещения алканов легче всего замещаются атомы водорода у третичных атомов углерода, затем у вторичных и, в последнюю очередь, у первичных. Для хлорирования эта закономерность не соблюдается при T>400˚C.
4 3 2 1
CH3-CH2-CH-CH3 + Cl2 hν → смесь галогеналканов.
│
CH3
1; 4 – первичные; 3 – вторичный; 2 – третичный.
б) Нитрование
(реакция М.И. Коновалова, он провёл её впервые в 1888 г)
CH4 + HNO3 t˚С → CH3NO2 + H2O
раствор нитрометан
R-NO2 или Сn H2n+1 – NO2 (нитроалкан)
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 788; Нарушение авторских прав?; Мы поможем в написании вашей работы!