
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вопрос № 5. Циклоалканы (циклопарафины). Строение. Физико-химические свойства, применение
|
|
|
|
Реакции окисления
Присоединение водорода происходит к наиболее гидрированному атому углерода при двойной углерод-углеродной связи.
OH
Реакции присоединения
Химические свойства алкенов
Для алкенов наиболее типичными являются реакции присоединения. В реакциях присоединения двойная связь выступает как донор электронов, поэтому для алкенов характерны реакции электрофильного присоединения.
1. Гидрирование (гидрогенизация – взаимодействие с водородом):
CnH2n + H2 t, Ni → CnH2n+2
2. Галогенирование (взаимодействие с галогенами):
CnH2n + Г2 → СnH2nГ2
CH2=CH2 + Br2 → CH2-CH2 (1,2-дибромэтан)
│ │
Br Br
Это качественная реакция алкенов – бромная вода Br2 (бурая жидкость) обесцвечивается.
3. Гидрогалогенирование* (взаимодействие с галогенводородами):
R-CH=CH2 + HГ → R-CH-CH3
│
Г
4. Гидратация* (присоединение молекул воды):
R-CH=CH2 + H-OH t,H3PO4 → R- CH-CH3
│
CH2=CH2 + H2O t,H3PO4 → CH3-CH2-OH (этанол – этиловый спирт)
* Присоединение галогенводородов и воды к несимметричным алкенам происходит по правилу Марковникова В.В.
Исключения!!!
1) Если в алкене присутствует электроноакцепторный заместитель, т.е. группа, способная оттягивать на себя электронную плотность:
F3C ← CH=CH2 + H-Br → F3C - CH2 - CH2(Br) 1,1,1- трифтор-3-бромпропан
2) Присоединение в присутствии Н2О2 (эффект Хараша) или органической перекиси
(R-O-O-R):
СH3-CH=CH2 + H-Br Н2О2 → H3C - CH2 - CH2(Br)
5. Реакции полимеризации:
nCH2=CH2 t, p, kat-TiCl4, Al(C2H5)3 → (-CH2-CH2-)n
мономер - этилен полимер – полиэтилен
nCH2=CH-CH3 t, p, kat → (-CH2-CH-)n
│
CH3
полимер – полипропилен
1. Горение:
CnH2n + 3n/2O2 t, p, kat → nCO2 + nH2O + Q (пламя ярко светящее)
| Частичное окисление этилена 2CH2=CH2 + O2 150-300, kat → 2 CH2-CH2 \ ⁄ O Оксид этилена – для органического синтеза |
2. Окисление перманганатом калия (р. Вагнера) в нейтральной среде– это качественная реакция алкенов, розовый раствор марганцовки обесцвечивается.
R-CH=CH2 + KMnO4 + H2O → R-CH-CH2 + MnO2↓ + KOH
│ │
OH OH
3CH2=CH2 + 2KMnO4 + 4H2O → 3CH2-CH2 + 2MnO2↓ + 2KOH
│ │
OH OH
(этиленгликоль)
Влияние среды на характер продуктов реакций окисления
1) Окисление в кислой среде при нагревании идёт до а) карбоновых кислот; б) кетонов (если атом углерода при двойной связи содержит два заместителя); в) углекислого газа (если двойная связь на конце молекулы, то образуется муравьиная кислота, которая легко окисляется до CO2):
а) 5CH3-CH=CH-CH3 + 8KMnO4 + 12H2SO4 → 10CH3COOH + 8MnSO4 +4K2SO4 + 12H2O
б) 5CH3 – C = CH – CH3+6KMnO4+9H2SO4 → 5CH3 – C – CH3+5CH3COOH+6MnSO4+3K2SO4+9H2O
│ ║
CH3 O
2-метилпропен ацетон
в) CH3 – CH2 – CH = CH2 + 2KMnO4 + 3H2SO4 → CH3CH2COOH + CO2 + 2MnSO4 + K2SO4 + 4H2O
2) Окисление в нейтральной или слабощелочной среде на холоде (см. выше
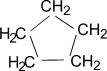
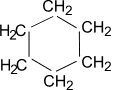
В отличие от предельных углеводородов, характеризующихся наличием открытых углеродных цепей, существуют углеводороды с замкнутыми цепями (циклами). По своим свойствам они напоминают обычные предельные углеводороды алканы (парафины), отсюда и произошло их название – циклоалканы (циклопарафины, нафтены). Общая формула гомологического ряда циклоалканов CnH2n. Представителями этого ряда соединений являются циклопропан, циклобутан, циклопентан, циклогексан.

| 
| 
| 
|
| Циклопропан | Циклобутан | Циклопентан | Циклогексан |
Очень часто в органической химии структурные формулы перечисленных циклоалканов изображают без символов C и H простыми геометрическими фигурами
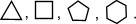
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 3218; Нарушение авторских прав?; Мы поможем в написании вашей работы!