
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Особенности составления химических формул соединений
|
|
|
|
Ответ.
Состояние атома с полностью или наполовину заполненным подуровнем (т. е. когда на каждой орбитали имеется по одному неспаренному электрону) является более устойчивым.
Этим объясняется «провал» электрона. Так, устойчивому состоянию атома хрома соответствует следующее распределение электронов:
Cr: 1s22s22p63s23p64s13d5, а не 1s22s22p63s23p64s23d4,
т. е. происходит «провал» электрона с 4s-подуровня на 3d-подуровень.
III. Семейства химических элементов.
- Элементы, в атомах которых происходит заполнение электронами s-подуровня внешнего энергетического уровня, называются s-элементами. Это первые 2 элемента каждого периода, составляющие главные подгруппы I и II групп.
- Элементы, в атомах которых электронами заполняется p-подуровень внешнего энергетического уровня, называются p-элементами. Это последние 6 элементов каждого периода (за исключением I и VII), составляющие главные подгруппы III-VIII групп.
- Элементы, в которых заполняется d-подуровень второго снаружи уровня, называются d-элементами. Это элементы вставных декад IV, V,VI периодов.
- Элементы, в которых заполняется f-подуровень третьего снаружи уровня, называются f-элементами. К f-элементам относятся лантаноиды и актиноиды.
Вопрос № 4. Типы химической связи. Ковалентная, ионная, металлическая, водородная
В природе не существуют одиночные атомы. Все они находятся в составе простых и сложных соединений, где их объединение в молекулы обеспечивается образованием химических связей друг с другом.
Образование химических связей между атомами – естественный, самопроизвольный процесс, так как при этом происходит понижение энергии молекулярной системы, т.е. энергия молекулярной системы меньше суммарной энергии изолированных атомов. Это движущая сила образования химической связи.
Природа химических связей – электростатическая, т.к. атомы есть совокупность заряженных частиц, между которыми действуют силы притяжения и отталкивания, которые приходят в равновесие.
В образовании связей участвуют неспаренные электроны, находящиеся на внешних атомных орбиталях (или готовые электронные пары) – валентные электроны. Говорят, что при образовании связей происходит перекрывание электронных облаков, в результате чего между ядрами атомов возникает область, где вероятность нахождения электронов обоих атомов максимальна.
Химическая связь - это взаимодействие атомов, осуществляемое путем обмена электронами.
При образовании химической связи атомы стремятся приобрести устойчивую восьмиэлектронную (или двухэлектронную – Н, Не) внешнюю оболочку, соответствующую строению атома ближайшего инертного газа, т.е. завершить свой внешний уровень.
Классификация химических связей.
1. По механизму образования химической связи.
а) обменный, когда оба атома, образующие связь, предоставляют для неё неспаренные электроны.
Например, образование молекул водорода Н2 и хлора Cl2:

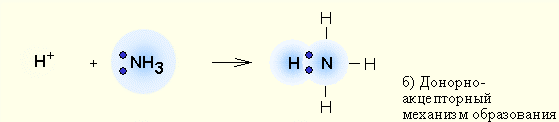
б) донорно – акцепторный, когда один из атомов предоставляет для образования связи готовую пару электронов (донор), а второй атом – пустую свободную орбиталь
Например, образование иона аммония (NH4)+ (заряженная частица):
2. По способу перекрывания электронных орбиталей.
а) σ- связь (сигма), когда максимум перекрывания лежит на линии, соединяющей центры атомов (одинарное перекрывание)
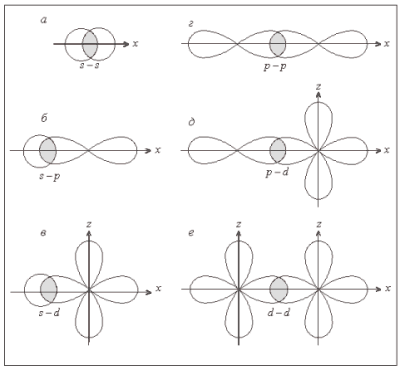
Например,
H2 σ(s-s)
Cl2 σ(p-p)
HCl σ(s-p)
б) π- связи (пи), если максимум перекрывания не лежит на линии, соединяющей центры атомов (двойное перекрывание)

3. По способу достижения завершенной электронной оболочки.
Каждый атом стремится завершить свою внешнюю электронную оболочку, при этом способов достижения такого состояния может быть несколько
| Признак сравнения | Ковалентная | Ионная | Металлическая | |
| неполярная | полярная | |||
| Как достигается завершенная электронная оболочка? | Обобществление электронов | Обобществление электронов | Полная передача электронов, образование ионов (заряженных частиц). | Обобществление электронов всеми атомами в крист. решетке |
| Какие атомы участвуют? | немет – немет ЭО = ЭО | 1) Немет-Немет1 2)Мет–немет ЭО < ЭО | мет +[немет]- ЭО << ЭО | В узлах находятся катионы и атомы металла. Связь осуществляют свободно перемещающиеся в межузловом пространстве электроны. |
| Примеры | простые вещества – неметаллы. | кислоты, оксиды | соли, щелочи, оксиды щелочных металлов. | простые вещества – металлы. Связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов в металлической кристаллической решетке. |
Вопрос № 5. Ковалентная связь. Виды ковалентной связи. Механизмы образования ковалентной связи (донорно-акцепторный, обменный). σ- и π- связи
Ковалентная связь осуществляется за счет электронной пары, принадлежащей обоим атомам.
По механизму образования различают обменный и донорно-акцепторный механизм образования ковалентной связи.
1) Обменный механизм. Каждый атом дает по одному неспаренному электрону в общую электронную пару:
| H• + •H → H: H | 
| → | 
|
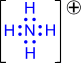
2) Донорно-акцепторный механизм. Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь;

| → | 
|
По способу перекрывания электронных орбиталей.
а) σ- связь (сигма), когда максимум перекрывания лежит на линии, соединяющей центры атомов (одинарное перекрывание)

Например,
H2 σ(s-s)
Cl2 σ(p-p)
HCl σ(s-p)
б) π- связи (пи), если максимум перекрывания не лежит на линии, соединяющей центры атомов (двойное перекрывание)

Два атома могут обобществлять неcколько пар электронов. В этом случае говорят о кратных связях:

| → | 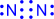
| (или NºN) – тройная связь |
Если электронная плотность расположена симметрично между атомами, ковалентная связь называется неполярной.
Если электронная плотность смещена в сторону одного из атомов, то ковалентная связь называется полярной.
Полярность связи тем больше, чем больше разность электроотрицательностей атомов.
Электроотрицательность - это способность атома притягивать электронную плотность от других атомов. Самый электроотрицательный элемент - фтор, самый электроположительный - франций.
Вопрос № 6. Ионная связь, ее образование. Заряды ионов. Степень окисления и валентность элементов
ИОННАЯ СВЯЗЬ (ИС) – образуется между атомами металлов и неметаллов, т.е. между атомами, резко отличающимися друг от друга по значениям электроотрицательности. (Например, NaCl, K2O, LiF)
Механизм образования связи.
Атом неметалла забирает наружные электроны у атома металла и превращается в анион (отрицательно заряженный ион). Атом металла теряет электроны и превращается в катион (положительно заряженный ион). Ионы связаны электростатическими силами. Происходит полная отдача (принятие) валентных электронов, перекрывание облаков отсутствует, обобществления электронов не наблюдается.
Рассмотрим механизм образования молекулы фторида натрия:
NaF – ис.
Электронная схема образования молекулы NaF:
| Na +11)2ē)8ē)1ē | Na0 – 1ē → Na+1 атом ион натрия натрия |
| F +9)2ē)7ē | F0 + 1ē → F-1 атом ион фтора фтора |

В результате образования связи электронная пара полностью сместилась к атому фтора, разноименно заряженные иона натрия и фтора притягиваются за счёт электростатического взаимодействия.
Валентность – это способность атомов присоединять к себе определенное число других атомов
Правила определения валентности
элементов в соединениях
1. Валентность водорода принимают за I (единицу). Тогда в соответствии с формулой воды Н2О к одному атому кислорода присоединено два атома водорода.
2. Кислород в своих соединениях всегда проявляет валентность II. Поэтому углерод в соединении СО2 (углекислый газ) имеет валентность IV.
3. Высшая валентность равна номеру группы.
4. Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент, т.е. 8 - Nгруппы.
5. У металлов, находящихся в «А» подгруппах, валентность равна номеру группы.
6. У неметаллов в основном проявляются две валентности: высшая и низшая.
Например: сера имеет высшую валентность VI и низшую (8 – 6), равную II; фосфор проявляет валентности V и III.
7. Валентность может быть постоянной или переменной.

Валентность элементов необходимо знать, чтобы составлять химические формулы соединений.
Запомните!
1) Низшую валентность проявляет тот элемент, который находится в таблице Д.И.Менделеева правее и выше, а высшую валентность – элемент, расположенный левее и ниже.
Например, в соединении с кислородом сера проявляет высшую валентность VI, а кислород – низшую II. Таким образом, формула оксида серы будет SO3.
В соединении кремния с углеродом первый проявляет высшую валентность IV, а второй – низшую IV. Значит, формула – SiC. Это карбид кремния, основа огнеупорных и абразивных материалов.
2) Атом металла стоит в формуле на первое место.
3) В формулах соединений атом неметалла, проявляющий низшую валентность, всегда стоит на втором месте, а название такого соединения оканчивается на «ид».
Например, СаО – оксид кальция, NaCl – хлорид натрия, PbS – сульфид свинца.
Теперь вы сами можете написать формулы любых соединений металлов с неметаллами.
4) Атом металла ставится в формуле на первое место.
Степень окисления – это условный заряд, который получает атом в результате полной отдачи (принятия) электронов, исходя из условия, что все связи в соединении ионные.
Рассмотрим строение атомов фтора и натрия:
F +9)2)7
Na +11)2)8)1
- Атому натрия легче отдавать электроны, фтору – принять электроны до завершения внешнего уровня.
F0 + 1ē → F-1 (нейтральный атом принимает один отрицательный электрон и приобретает степень окисления «-1», превращаясь в отрицательно заряженный ион - анион)
Na0 – 1ē → Na+1 (нейтральный атом отдаёт один отрицательный электрон и приобретает степень окисления «+1», превращаясь в положительно заряженный ион - катион)

| - Процесс отдачи электронов атомом, называется окислением. - Атом, отдающий электроны и повышающий свою степень окисления, окисляется и называется восстановителем. - Процесс принятия электронов атомом, называется восстановлением. - Атом, принимающий электроны и понижающий свою степень окисления, восстанавливается и называется окислителем. |
Как определить значение степени окисления атомов в химической формуле?

Вопрос № 7. Типы кристаллических решеток веществ. Зависимость свойств веществ от типа кристаллической решетки.
Типы кристаллических решёток.
Любое химическое вещество образованно большим числом одинаковых частиц, которые связаны между собою.
При низких температурах, когда тепловое движение затруднено, частицы строго ориентируются в пространстве и образуют кристаллическую решётку.
Кристаллическая решетка – это структура с геометрически правильным расположением частиц в пространстве.
В самой кристаллической решетке различают узлы и межузловое пространство.
Одно и то же вещество в зависимости от условий (p, t,…) существует в различных кристаллических формах (т.е. имеют разные кристаллические решетки) – аллотропных модификациях, которые отличаются по свойствам.
Например, известно четыре модификации углерода – графит, алмаз, карбин и лонсдейлит.
☼ Четвёртая разновидность кристаллического углерода «лонсдейлит» мало кому известна. Он обнаружен в метеоритах и получен искусственно, а строение его ещё изучается.
☼ Сажу, кокс, древесный уголь относили к аморфным полимерам углерода. Однако теперь стало известно, что это тоже кристаллические вещества.
☼ Кстати, в саже обнаружили блестящие чёрные частицы, которые назвали «зеркальным углеродом». Зеркальный углерод химически инертен, термостоек, непроницаем для газов и жидкостей, обладает гладкой поверхностью и абсолютной совместимостью с живыми тканями.
☼ Название графита происходит от итальянского «граффитто» - пишу, рисую. Графит представляет собой тёмно – серые кристаллы со слабым металлическим блеском, имеет слоистую решётку. Отдельные слои атомов в кристалле графита, связанные между собой сравнительно слабо, легко отделяются друг от друга.
ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЁТОК
Любое химическое вещество образованно большим числом одинаковых частиц, которые связаны между собою.
При низких температурах, когда тепловое движение затруднено, частицы строго ориентируются в пространстве и образуют кристаллическую решётку.
Кристаллическая решетка – это структура с геометрически правильным расположением частиц в пространстве.
В самой кристаллической решетке различают узлы и межузловое пространство.
Одно и то же вещество в зависимости от условий (p, t,…) существует в различных кристаллических формах (т.е. имеют разные кристаллические решетки) – аллотропных модификациях, которые отличаются по свойствам.
Например, известно четыре модификации углерода – графит, алмаз, карбин и лонсдейлит.
☼ Четвёртая разновидность кристаллического углерода «лонсдейлит» мало кому известна. Он обнаружен в метеоритах и получен искусственно, а строение его ещё изучается.
☼ Сажу, кокс, древесный уголь относили к аморфным полимерам углерода. Однако теперь стало известно, что это тоже кристаллические вещества.
☼ Кстати, в саже обнаружили блестящие чёрные частицы, которые назвали «зеркальным углеродом». Зеркальный углерод химически инертен, термостоек, непроницаем для газов и жидкостей, обладает гладкой поверхностью и абсолютной совместимостью с живыми тканями.
☼ Название графита происходит от итальянского «граффитто» - пишу, рисую. Графит представляет собой тёмно – серые кристаллы со слабым металлическим блеском, имеет слоистую решётку. Отдельные слои атомов в кристалле графита, связанные между собой сравнительно слабо, легко отделяются друг от друга
ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЁТОК
| ионная | атомная | молекулярная | металлическая | |
| Что в узлах кристаллической решётки, структурная единица | ионы

| атомы
| молекулы
| атомы и катионы
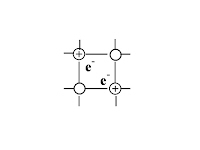
|
| Тип химической связи между частицами узла | ионная | ковалентная: полярная и неполярная | ковалентная: полярная и неполярная | металлическая |
| Силы взаимодействия между частицами кристалла | электростати- ческие | ковалентные | межмолекуляр- ные | электростати- ческие |
| Физические свойства, обусловленные кристаллической решёткой | · силы притяжения между ионами велики, · Тпл.↑ (тугоплавкте), · легко растворяются в воде, · расплав и р-р проводит эл.ток, · нелетучи (не имеют запаха) | · ковалентные связи между атомами велики, · Тпл. и Tкип очень↑, · в воде не растворяются, · расплав не проводит эл.ток | · силы притяжения между молекулами невелики, · Тпл.↓, · некоторые растворяются в воде, · обладают запахом – летучи | · силы взаимодействия велики, · Тпл.↑, · Высокие тепло и электропроводность |
| Агрегатное состояние вещества при обычных условиях | твёрдое | твёрдое | твёрдое, газообразное, жидкое | твёрдое, жидкое(Нg) |
| Примеры | большинство солей, щелочей, оксиды типичных металлов | С (алмаз, графит), Si, Ge, B,SiO2, CaC2, SiC (карборунд), BN, Fe3C,TaC(tпл.=38000С) Красный и чёрный фосфор. Оксиды некоторых металлов. | все газы, жидкости, большинство неметаллов: инертные газы, галогены, H2,N2, O2, O3, P4 (белый), S8. Водородные соединения неметаллов, оксиды неметаллов: H2O, CO2 «сухой лёд». Большинство органических соединений. | Металлы, сплавы |
Если скорость роста кристаллов мала при охлаждении – образуется стеклообразное состояние (аморфное).
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1455; Нарушение авторских прав?; Мы поможем в написании вашей работы!