
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства аминокислот
|
|
|
|
СТРУКТУРА И ФИЗИЧЕСКИЕ СВОЙСТВ АМИНОКИСЛОТ
По физическим и ряду химических свойств аминокислоты резко отличаются от соответствующих кислот и оснований (см. табл. 1 и 2). Они лучше растворимы в воде, чем в органических растворителях; хорошо кристаллизуются; имеют высокую плотность и исключительно высокие температуры плавления (часто разложения). Эти свойства указывают на взаимодействие аминных и кислотных групп, вследствие чего аминокислоты в твердом состоянии и в растворе (в широком интервале рН) находятся в цвиттер-ионной форме. Например, для глицина кислотно-основное равновесие:
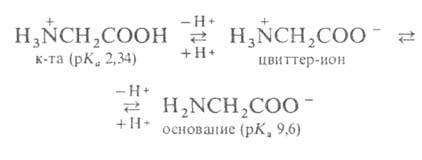
Реакции по карбоксильным группам аминокислот, аминогруппа которых защищена ацилированием или солеобразованием, протекают аналогично превращениям карбоновых кислот. Аминокислоты легко образуют соли,сложные эфиры. амиды, гидразиды, азиды, тиоэфиры, галогенангидриды, смешанные ангидриды и т.д. Эфиры аминокислот под действием натрия или магнийорганических соединений превращаются в аминоспирты. При сухойперегонке в присутствии Ва(ОН)2 аминокислоты декарбоксилируются.
Реакции аминогрупп аминокислот аналогичны превращениям аминов. Аминокислоты образуют соли с минеральными кислотами и пикриновой кислотой, легко ацилируются хлорангидридами кислот в водно-щелочном растворе (реакция Шоттена-Баумана) и алкилируются алкилгалогенидами. Метилиодид и диазометан превращают аминокислоты вбетаины (CH3)3N+CHRCOO-. С формалином аминокислоты дают мегилольные или метиленовые производные, а в присутствии муравьиной кислоты или каталитически активированного Н2 - N,N-диметиламинокислоты. Под действием HNO2 ароматические аминогруппы диазотируются, а алифатические замещаются на гидроксил. При обработке эфиров аминокислоты изоцианатами и изотиоцианатами образуются производные мочевины и тиомочевины. При нагревании ссодой или при одновременном воздействии алкоголята и СО2 аминокислоты дают соли или эфиры N-карбоксипроизводных аминокислот, а при использовании CS2-аналогичные дитиокарбаматы.
Реакции с одновременным участием групп NH2 и СООН наиболее характерны для α-аминокислот, которые способны образовывать устойчивые 5-членные гетероциклы. С ионами переходных металлов (Си, Zn, Ni, Co, Pb, Ag, Hg, Cr) α-аминокислоты образуют прочные хелатные комплексы, что используется в комплексонах и в комплексообразующих ионообменных смолах на основе аминокарбоновых и аминофосфоновых кислот. При взаимодейсвтии с фосгеном α-аминокислоты превращаются в циклические ангидриды N-карбоксиаминокислот (ф-ла I), а при нагревании с уксусным ангидридом или ацетилхлоридом - в азлактоны (II); нагревание аминокислоты с мочевиной или обработкаизоцианатами дает гидантоины (III), а при использовании α-аминокислот, и особенно легко их эфиры, при нагревании превращаются в 2,5-пиперазиндионы, или дикетопиперазины (V). β-аминокислоты при нагревании дезаминируются и образуют α,β-ненасыщенные кислоты, γ- и δ-аминокислоты отщепляют воду и образуют 5- и 6-членные лактамы. ε-аминокапроновая кислота при нагревании образует в основном полиамид и лишь частично превращается в капролактам, что характерно и для аминокислот с большим числом метиленовых звеньев между функциональными группами. Бетаины α-аминокислот при нагревании могут обратимо превращаться в эфиры диметиламинокислот, например:
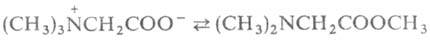
Наибольший интерес представляют 20 L-α-аминокислот (аланин, аргинин, аспарагин и другие), входящих в состав белковых молекул. Смеси L-аминокислот, а также индивидуальные аминокислоты (например, метионин) применяют в медицине для парэнтерального питания больных с заболеваниями пищеварительных и других органов, при нарушениях обмена веществ и др.; лизин, метионин, треонин, триптофан - в животноводстве для обогащения кормов; глутамат натрия и лизин - в пищевой промышленности. ω-аминокислоты и их лактамы служат для промышленного производства полиамидов. γ-аминомасляная кислота (аминалон) - медиатор в центральной нервной системе, применяется как лекарственное средствово при сосудистых заболеваниях головного мозга. Ароматические аминокислоты используют в синтезе красителей и лекарственных средств. На основе аминокарбоновых и аминофосфоновых кислот синтезируют селективные комплексоны, комплексообразующие иониты, лигандообменные сорбенты, ПАВ.
30.Мезомерный эффект заместителей.
Мезомерный эффект (эффект сопряжения, резонансный эффект) — смещение электронной плотности химической связи по π-связям. Объясняется теориейхимического резонанса.
Возникновение мезомерного эффекта связано с изменением профиля π-системы молекулы. Исходная π-система перекрывается с π-системой или p-орбиталью заместителя, в результате чего возникает перераспределение электронной плотности. Именно последнее определяет наличие +М- или -М-эффекта. Знак, как и в случае индуктивного эффекта определяется прибавлением электронной плотности и противоположен знаку параметра заместителя σ в уравнении Гаммета.
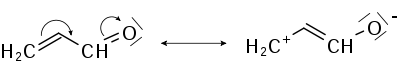

-М эффект
В отличие от индуктивного эффекта мезомерный эффект слабо затухает по системе связей, с тем лишь отличием, что в данном случае необходима система кратных связей и p-орбиталей.
Наиболее характерными +М-группами являются группы, вносящие неподелённые электронные пары в сопряжённую систему, такие как амино-, гидрокси-, алкоксигруппы, галогены;
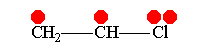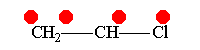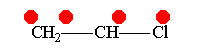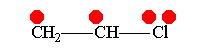

Винилхлорид +М-эффект
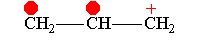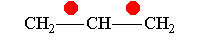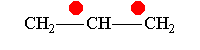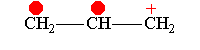

Аллил-катион -М-эффект
группы с -М-эффектом содержат кратные связи с гетероатомами. Можно привести аналогию с разными типами атомов азота в гетероциклах:
· для +М характерны пиррольные гетероатомы;
· для -М характерны пиридиновые гетероатомы.
-М-группами являются карбонильная группа, цианогруппа и т. п.
Группы с системой сопряжённых углерод-углеродных связей, таких как фенильная и винильная группы, занимают промежуточное положение с так называемым ±М-эффектом и проявляют эффект, противоположный эффекту группы, с которой связаны, усиливая его.
Важная особенность мезомерного эффекта - альтернирующий характер обусловливаемой им поляризации. Так, + М-эффект группы ОН приводит к увеличению электронной плотности в орто- и пара -положениях бензольного кольца (формула I), чем и объясняется электрофильное замещение только по этим положениям. Заместители с -М-эффектом понижают электронную плотность в орто- и пара -положениях бензольного кольца (II); этим объясняется электрофильная атака в мета-положения таких молекул.
31.Пептиды.
Пептиды (греч. πεπτος — питательный) — семейство веществ, молекулы которых построены из двух и более остатковаминокислот, соединённых в цепь пептидными (амидными) связями —C(O)NH—. Обычно подразумеваются пептиды, состоящие из α-аминокислот, однако термин не исключает пептидов, полученных из любых других аминокарбоновых кислот.[1]
Пептиды, последовательность которых короче примерно 10-20 аминокислотных остатков могут также называтьсяолигопептидами, при большей длине последовательности они называются полипептидами. Белками обычно называют полипептиды, содержащие примерно от 50 аминокислотных остатков.[2]
В 1900 году немецкий химик-органик Герман Эмиль Фишер выдвинул гипотезу о том, что пептиды состоят из цепочки аминокислот, образованных определёнными связями. И уже в 1902 году он получил неопровержимые доказательства существования пептидной связи, а к 1905 году разработал общий метод, при помощи которого стало возможным синтезировать пептиды в лабораторных условиях.
Постепенно учёные изучали строение различных соединений, разрабатывали методы разделения полимерных молекул на мономеры, синтезировали все больше и больше пептидов. На сегодняшний день известно более 1500 видов пептидов, определены их свойства и разработаны методы синтеза.
· Полипептиды могут иметь в молекуле неаминокислотные фрагменты, например углеводные остатки.
· Природные и синтетические полипептиды с молекулярной массой более 5000[3](6000[4])-10000[5][6] дальтон называютбелками.
Пептиды постоянно синтезируются во всех живых организмах для регулирования физиологических процессов. Свойства пептидов зависят, главным образом, от ихпервичной структуры — последовательности аминокислот, а также от строения молекулы и её конфигурации в пространстве (вторичная структура).
Пептидная (амидная) связь — это вид химической связи, которая возникает вследствие взаимодействия α-аминогруппы одной аминокислоты и α-карбоксигруппы другой аминокислоты. Амидная связь очень прочная, и в нормальных клеточных условиях (37 °C, нейтральный ph) самопроизвольно не разрывается. Пептидная связь разрушается при действии на неё специальных протеолитических ферментов (протеаз, пептидгидролаз).
Синтез пептидов [править | править исходный текст]
Образование пептидов в организме происходит в течение нескольких минут, химический же синтез в условиях лаборатории — достаточно длительный процесс, который может занимать несколько дней, а разработка технологии синтеза – несколько лет. Однако, несмотря на это, существуют довольно весомые аргументы в пользу проведения работ по синтезу аналогов природных пептидов. Во-первых, путём химической модификации пептидов возможно подтвердить гипотезу первичной структуры. Аминокислотные последовательности некоторых гормонов стали известны именно благодаря синтезу их аналогов в лаборатории.
Во-вторых, синтетические пептиды позволяют подробнее изучить связь между структурой аминокислотной последовательности и её активностью. Для выяснения связи между конкретной структурой пептида и его биологической активностью была проведена огромная работа по синтезу не одной тысячи аналогов. В результате удалось выяснить, что замена лишь одной аминокислоты в структуре пептида способна в несколько раз увеличить его биологическую активность или изменить её направленность. А изменение длины аминокислотной последовательности помогает определить расположение активных центров пептида и участка рецепторного взаимодействия.
В-третьих, благодаря модификации исходной аминокислотной последовательности, появилась возможность получать фармакологические препараты. Создание аналогов природных пептидов позволяет выявить более «эффективные» конфигурации молекул, которые усиливают биологическое действие или делают его более продолжительным.
В-четвёртых, химический синтез пептидов экономически выгоден. Большинство терапевтических препаратов стоили бы в десятки раз больше, если бы были сделаны на основе природного продукта.
Зачастую активные пептиды в природе обнаруживаются лишь в нанограммовых количествах. Плюс к этому, методы очистки и выделения пептидов из природных источников не могут полностью разделить искомую аминокислотную последовательность с пептидами противоположного или же иного действия. А в случае специфических пептидов, синтезируемых организмом человека, получить их возможно лишь путём синтеза в лабораторных условиях.
32.Химическое строение и структурная изомерия.
Изомерия (от др.-греч. ἴσος — «равный», и μέρος — «доля, часть») — явление, заключающееся в существовании химических соединений (изомеров), одинаковых по составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и, вследствие этого, по свойствам.
Структурная изомерия[править | править исходный текст]
Структурная изомерия — результат различий в химическом строении. К этому типу относят:
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1618; Нарушение авторских прав?; Мы поможем в написании вашей работы!