
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ориентация и реакционная способность
Механизм ароматического электрофильного замещения.
Большинство реакций ароматического электрофильного замещения протекает по единому механизму:
Реакция начинается с образования p -комплекса, в котором p -электронная система ароматического ядра выступает как донор электронов, а электрофильный реагент (Е+) действует как акцептор. Далее p -комплекс с нарушением ароматической системы медленно перегруппировывается в s -комплекс, в котором электрофил связан s -связью с определенным атомом углерода, а положительный заряд делокализован по сопряженной системе бывшего ароматического кольца. Делокализация положительного заряда в s -комплексе происходит в основном за счет о- и п-положений по отношению к вступающему заместителю, что может быть показано с помощью набора резонансных структур
На последней стадии происходит отщепление протона от s -комплекса под действием основания с восстановлением ароматической системы. Лимитирующей стадией в процессе электрофильного замещения является стадия образования s -комплекса.
Ход реакции и ее механизм иллюстрирует энергетическая диаграмма, представленная на рисунке:
Если бензольное кольцо уже содержит заместитель, то:
1. реакция может протекать быстрее или медленнее, чем с самим бензолом;
2. возможно образование трех разных продуктов замещения
Влияние имеющегося в бензольном кольце заместителя можно объяснить исходя из его электронных эффектов. По этому признаку заместители можно разделить на 3 основных группы: 1. Заместители, ускоряющие реакцию по сравнению с незамещенным бензолом (активирующие) и направляющие замещение в орто,- пара- положения.
2. Заместители, замедляющие реакцию (дезактивирующие) и направляющие замещение в орто,-пара- положения.
3. Заместители, замедляющие реакцию (дезактивирующие) и направляющие замещение в мета - положения.
Заместители, отмеченные в п.п. 1,2 (орто-,пара-ориентанты) называются заместителями I-го рода; отмеченные в п.3 (мета-ориентанты) - заместителями II-го рода. Ниже приведено отнесение обычно встречающихся заместителей в соотвествие с их электронными эффектами.
Особый случай представляют собой галогены - будучи заместителями в бензольном ядре, они дезактивируют его в реакциях электрофильного замещения, однако являются орто -, пара- ориентантами. Дезактивация (снижение скорости реакции с электрофилами) связана с тем, что, в отличие других группировок с неподеленными электронными парами (таких как -OH, -NH2 и т.п.), обладающих положительным мезомерным (+М) и отрицательным индуктивным эффектом (-I), для галогенов характерно преобладание индуктивного эффекта над мезомерным (+М< -I).
В то же время, атомы галогенов являются орто,пара -ориентантами, поскольку способны за счет положительного мезомерного эффекта участвовать в делокализации положительного заряда в s -комплексе, образующемся при орто - или пара - атаке (структуры IV, VII в приведенной выше схеме), и тем самым снижают энергию его образования.
Если в бензольном ядре имеется не один, а два заместителя, то их ориентирующее действие может совпадать (согласованная ориентация) или не совпадать (несогласованная ориентация). В первом случае можно рассчитывать на преимущественное образование каких-то определенных изомеров, а во втором будут получаться сложные смеси.
Ниже приведены некоторые примеры согласованной ориентации двух заместителей; место преимущественного вступления третьего заместителя показано стрелкой.
Примеры реакций электрофильного замещения.
Нитрование
Нитрование, как правило, проводят смесью концентрированных азотной и серной кислот, так называемой нитрующей смесью. На первой стадии реакции происходит образование электрофильного агента - иона нитрония +NO2:
Затем катион нитрония вступает в реакцию с ароматическим субстратом, например бензолом:
Галогенирование
В отличие от нитрования, при галогенировании атака ароматического субстрата может осуществляться различными электрофилами. Свободные галогены, например, Cl2 и Br2, могут легко атаковать активированное ароматическое ядро (например, фенола), но не способны реагировать с бензолом и алкилбензолами. Для поляризации атакующей молекулы галогена необходим катализ кислотами Льюиса, такими как AlCl3, FeBr3, и т.п.; при этом в молекуле галогена появляется так называемый "электрофильный конец" (энергия же, требующаяся для образования катиона Наl+ существенно выше). Тем самым электрофильное замещение существенно облегчается:
Сульфирование
Арены взаимодействуют с концентрированной серной кислотой или олеумом (раствор SO3 в серной кислоте) с образованием аренсульфокислот:
ArH + H2SO4 ® ArSO3H + H2O
Электрофильной частицей является SO3. Атаку ароматического субстрата осуществляет атом серы, поскольку он сильно положительно поляризован, то есть электронодефицитен:
Сульфирование является обратимым процессом. Сульфогруппа может удаляться из ароматического ядра, что широко используется в органическом синтезе
38. Реакции электрофильного присоединения к алкенам.
AdE реакции – основной тип превращений алкенов. По электрофильному механизму к алкенам могут присоединяться галогены, галогеноводороды, серная кислота, вода и другие электрофильные реагенты.
Общий механизм реакции включает ряд последовательных стадий:
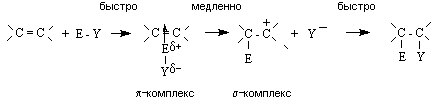
На первой стадии электрофил образует p -комплекс с алкеном, в котором двойная связь выступает как донор, а электрофил как акцептор электронов. Далее p -комплекс медленно перегруппировывается в карбокатион (s -комплекс). На последней стадии происходит быстрое взаимодействие карбокатиона с нуклеофилом (Y -) с образованием продукта присоединения. Скорость-определяющей стадией процесса является стадия образования s -комплекса. Ее скорость, а, следовательно, и скорость процесса в целом, зависит от стабильности интермедиата – карбокатиона, который близок по энергии к переходному состоянию лимитирующей стадии.
Относительная стабильность карбокатионов зависит от возможности делокализации в них положительного заряда. Алкильные группы обладают способностью понижать положительный заряд на соседнем атоме углерода за счет +I-эффекта. Поэтому стабильность карбокатионов возрастает в ряду:
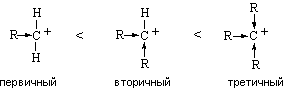
Таким образом, электронодонорные заместители (алкильные группы) увеличивают реакционную способность алкенов, так как, с одной стороны, повышают электронную плотность двойной связи, с другой стороны, стабилизируют карбокатион. Электроноакцепторные заместители действуют в противоположном направлении.
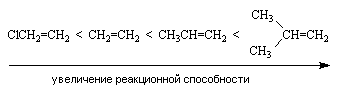
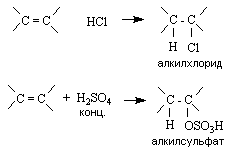
Присоединение протонных кислот
Галогеноводороды и концентрированная серная кислота взаимодействуют с алкенами с образованием соответственно алкилгалогенидов и алкилсульфатов:
Реакционная способность кислот зависит от их силы и возрастает в ряду: HF < HCl < HBr < HI
Механизм реакции:

При присоединении кислот к несимметрично замещенным алкенам возможно образование двух разных продуктов. Реакция протекает региоселективно. Согласно правилу Марковникова, водород присоединяется к наиболее гидрированному атому углерода:
R-CH=CH2 + HCl ® R-CHCl-CH3
Направление присоединения определяется относительной стабильностью промежуточно образующихся карбокатионов:
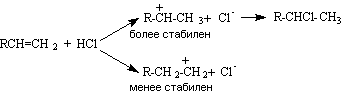
Реакция идет в направлении образования наиболее стабильного вторичного карбокатиона, который образуется с большей скоростью.
Правило Марковникова не является универсальным. Оно может нарушаться в случае изменения механизма реакции, а также при присоединении кислот к алкенам, содержащим электроноакцепторные заместители, обладающие –I-эффектом (CF3, +N(CH3)3) или –I- и –М-эффектами (CHO, COOH, CN), например:
CF3CH=CH2 + HCl ® CF3CH2CH2Cl
В этом случае реакция также протекает в направлении образования наименее дестабилизированного интермедиата, которым является первичный карбокатион, так как в нем электроноакцепторный заместитель не расположен в непосредственной близости от положительно заряженного атома углерода:
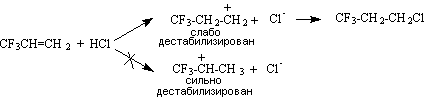
С учетом приведенных фактов можно сформулировать следующее правило:
Электрофильное присоединение несимметричных реагентов к несимметричным алкенам протекает в направлении образования наиболее стабильного карбокатиона.
Это правило позволяет предсказать строение продуктов присоединения к алкенам не только соединений типа HX, но и других несимметричных реагентов (ICl, HOCl).
39. Гетероциклические соединения.
Гетероциклические соединения (гетероциклы) — органические соединения, содержащие циклы, в состав которых наряду с углеродом входят и атомы других элементов. Могут рассматриваться как карбоциклические соединения с гетерозаместителями (гетероатомами) в цикле. Наиболее разнообразны и хорошо изучены ароматические азотсодержащие гетероциклические соединения. Предельные случаи гетероциклических соединений — соединения, не содержащие атомов углерода в цикле, например, пентазол.
Особенности реакционной способности гетероциклических соединений по сравнению с их карбоциклическими аналогами обуславливаются именно такими гетерозаместителями. В качестве гетероатомов чаще всего выступают элементы второго периода (N, O) и S, реже — Se, P, Si и др. элементы. Как и в случае карбоциклических соединений, наиболее специфические свойства гетероциклических соединений проявляют ароматические гетероциклические соединения (гетероароматические соединения). В отличие от атомов углерода карбоциклических ароматических соединений, гетероатомы могут отдавать в ароматическую систему не только один (гетероатомы пиридинового типа), но и два (гетероатомы пиррольного типа) электрона. Гетероатомы пиррольного типа обычно входят в состав пятичленных циклов (пиррол, фуран, тиофен). В одном гетероцикле могут сочетаться оба типа гетероатомов (имидазол, оксазол). Особенности реакционной способности гетероароматических соединений определяются распределением электронной плотности в цикле, которая, в свою очередь, зависит от типов гетероатомов и их электроотрицательности.
В химии гетероциклические соединения в силу исторических причин широко применяются тривиальные названия; так, например, при именовании пяти- и шестичленных соединений, содержащих 1 или 2 гетероатома N, O или S в подавляющем большинстве случаев используются тривиальные названия.
Систематическая номенклатура гетероциклических соединений строится по правилам, предложенным Ганчем и Видманом.
Гетероароматические соединения подразделяют на электроноизбыточные и электронодефицитные. К первым относят 5-членные гетероциклические соединения с одним гетероатомом, в которых секстет электронов делокализован между пятью атомами цикла, что обусловливает их повышенную активность по отношению к электрофильным агентам. К  дефицитным относят 6-членные гетероциклы с шестью
дефицитным относят 6-членные гетероциклы с шестью  электронами, которые распределяются, как и в случае бензола, между шестью атомами кольца, но один или несколько из них - гетероатомы с большей, чем у углерода, электроотрицательностью. Такие соединения напоминают по реакционной способности производные бензола, несущие ориентанты II рода. Пятичленные гетероароматические соединения с несколькими гетероатомами по формальному признаку можно было бы считать также электроноизбыточными, однако наличие двух и более гетероатомов с их высокой электроотрицательностью, а также способность превращаться в условиях электрофильного замещения в соответствующие катионы обусловливает то, что эти соединения по реакционной способности во многом близки к электронодефицитным гетероциклическим соединениям; их иногда называют
электронами, которые распределяются, как и в случае бензола, между шестью атомами кольца, но один или несколько из них - гетероатомы с большей, чем у углерода, электроотрицательностью. Такие соединения напоминают по реакционной способности производные бензола, несущие ориентанты II рода. Пятичленные гетероароматические соединения с несколькими гетероатомами по формальному признаку можно было бы считать также электроноизбыточными, однако наличие двух и более гетероатомов с их высокой электроотрицательностью, а также способность превращаться в условиях электрофильного замещения в соответствующие катионы обусловливает то, что эти соединения по реакционной способности во многом близки к электронодефицитным гетероциклическим соединениям; их иногда называют  -амфотерными.
-амфотерными.
Насыщенные, а также лишенные ароматичности ненасыщенные гетероциклические соединения с пятью и болееатомами в цикле напоминают по хим. свойствам соответствующие соединения с открытой цепью-амины, эфиры, сульфиды и др.
40.Механизм разрыва химической связи.
41//
Наиболее важными реакциями этого типа являются нитрование, галогенирование, сульфирование, алкилирование, ацилирование.Механизм ароматического электрофильного замещения.Большинство реакций ароматического электрофильного замещения протекает по единому механизму:Реакция начинается с образования p -комплекса, в котором p -электронная система ароматического ядра выступает как донор электронов, а электрофильный реагент (Е+) действует как акцептор. Далее p -комплекс с нарушением ароматической системы медленно перегруппировывается в s -комплекс, в котором электрофил связан s -связью с определенным атомом углерода, а положительный заряд делокализован по сопряженной системе бывшего ароматического кольца. Делокализация положительного заряда в s -комплексе происходит в основном за счет о- и п-положений по отношению к вступающему заместителю, что может быть показано с помощью набора резонансных структурНа последней стадии происходит отщепление протона от s -комплекса под действием основания с восстановлением ароматической системы. Лимитирующей стадией в процессе электрофильного замещения является стадия образования s -комплекса. Ориентация и реакционная способность
Если бензольное кольцо уже содержит заместитель, то:
реакция может протекать быстрее или медленнее, чем с самим бензолом;
возможно образование трех разных продуктов замещения
Влияние имеющегося в бензольном кольце заместителя можно объяснить исходя из его электронных эффектов. По этому признаку заместители можно разделить на 3 основных группы: 1. Заместители, ускоряющие реакцию по сравнению с незамещенным бензолом (активирующие) и направляющие замещение в орто,- пара- положения. 2. Заместители, замедляющие реакцию (дезактивирующие) и направляющие замещение в орто,-пара- положения. 3. Заместители, замедляющие реакцию (дезактивирующие) и направляющие замещение в мета - положения.Заместители, отмеченные в п.п. 1,2 (орто-,пара-ориентанты) называются заместителями I-го рода; отмеченные в п.3 (мета-ориентанты) - заместителями II-го рода. Ниже приведено отнесение обычно встречающихся заместителей в соотвествие с их электронными эффектами. Примеры реакций электрофильного замещения.
Нитрование … Нитрование, как правило, проводят смесью концентрированных азотной и серной кислот, так называемой нитрующей смесью. На первой стадии реакции происходит образование электрофильного агента - иона нитрония +NO2: Затем катион нитрония вступает в реакцию с ароматическим субстратом, например бензолом: Галогенирование.. В отличие от нитрования, при галогенировании атака ароматического субстрата может осуществляться различными электрофилами. Свободные галогены, например, Cl2 и Br2, могут легко атаковать активированное ароматическое ядро (например, фенола), но не способны реагировать с бензолом и алкилбензолами. Для поляризации атакующей молекулы галогена необходим катализ кислотами Льюиса, такими как AlCl3, FeBr3, и т.п.; при этом в молекуле галогена появляется так называемый "электрофильный конец" (энергия же, требующаяся для образования катиона Наl+ существенно выше). Тем самым электрофильное замещение существенно облегчается: Сульфирование… Арены взаимодействуют с концентрированной серной кислотой или олеумом (раствор SO3 в серной кислоте) с образованием аренсульфокислот: ArH + H2SO4 ® ArSO3H + H2O Электрофильной частицей является SO3. Атаку ароматического субстрата осуществляет атом серы, поскольку он сильно положительно поляризован, то есть электронодефицитен:
Сульфирование является обратимым процессом. Сульфогруппа может удаляться из ароматического ядра, что широко используется в органическом синтезе.
|
|
Дата добавления: 2015-04-24; Просмотров: 914; Нарушение авторских прав?; Мы поможем в написании вашей работы!