
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Індикаторні електроди
|
|
|
|
В методі кислотно-основної взаємодії широко використовують скляний електрод, якийвиготовляють із скла певних сортів, підбираючи їх так, щоб мембрана проявляла підвищену селективність до іона, що визначається. Першим електродом зі скляною мембраною був електрод, селективний відносно Н+-іонів, який витіснив всі інші електроди, що застосовувалися для вимірювання рН. Його дія заснована на виникненні різниці потенціалів між тонкою скляною плівкою й водяними розчинами з певною концентрацією (активністю водневих іонів). Воднева функція скляного електроду, тобто залежність різниці потенціалів від активності іонів водню в розчині, обумовлена їхньою дифузією в скло. Пізніше були створені скляні електроди для визначення інших іонів (К+, Nа+, Аg+ ). Cучасний скляний електрод для вимірювання рН зображений на рис. 21.


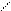















 6
6
Рис.21. Скляний електрод
1 - скляна рН-чутлива 
 мембрана;
мембрана;
 2 – 0,1 моль/л розчин НСl, насиче- 4
2 – 0,1 моль/л розчин НСl, насиче- 4
ний АgСl, 3 – срібний дріт;
4 - скляна трубка;
 5 – ізоляція; 6 - струмовідвід. 3
5 – ізоляція; 6 - струмовідвід. 3
 1
1
Головна його частина – тонка скляна мембрана зі спеціального сорту скла у формі кульки (1), припаяна до скляної трубки (4). Внутрішню частину кульки заповнюють 0,1 моль/л розчином хлористо-водневої кислоти, насичений хлоридом срібла (2), вставляють срібний дріт (3), що служить внутрішнім електродом порівняння.
Скляний електрод придатний для виміру рН в області від 0÷13. Він нечутливий до різних домішок у розчині, не отруюється. Рівновага між електродом і розчином встановлюється дуже швидко. Недоліком є крихкість скляної кульки (плівки).
Скляні іоноселективні електроди широко використовують також для визначення катіонів лужних металів в різних біологічних пробах - крові, плазмі, сироватках і т.д., в об'єктах навколишнього середовища - водах, рослинах, різних екстрактах і т.д. Визначення за допомогою іонселективних електродів успішно конкурують із полум’яно-фотометричними методами за точністю й експресністю.
В методах осадження і комплексоутворення як індикаторні використовують електроди, потенціал яких залежить від концентрації іонів, що беруть участь в реакції осадження чи комплексоутворення. Наприклад, для визначення срібла потенціометричним методом можна використати срібний електрод. Його ж можна використовувати для визначення іонів, що дають з іонами срібла малорозчинні осади або стійкі комплексні сполуки.
В методах окислення-відновлення як індикаторні електроди використовують індиферентні у відношенні до іона, що визначється, метали – платину Pt, золото Au, паладій Pd та інш. Індикаторні електроди не беруть участь в окисно-відновній реакції, вони служать лише для вимірювання величини потенціалу даної окисно-відновної пари по відношенню до стандарт-ного електрода. Наприклад, якщо при окисно-відновному титруванні іонів двовалентного заліза діхроматом калію в розчин, який титрується опустити платиновий електрод і з’єднати його з електродом порівняння, то до точки еквівалентності платиновий електрод буде показувати зміну потенціалу системи 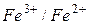 , а після точки еквівалентності – потенціалу системи
, а після точки еквівалентності – потенціалу системи 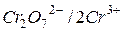 .
.
Електроди порівняння.
Основна вимога до будь-якого електрода порівняння – це сталость його потенціалу. Незалежно від того, чи занурений електрод порівняння в досліджу-вавний розчин, чи зєднаний з досліджуваним розчином електролітичним містком, він не повинен реагувати на зміну концентрації іона, що визначається. Як електроди порівняння найчастіше використовують водневий, каломельний і хлорсрібний електроди.
Водневий електрод- представляє собою платиновий дріт чи пластину, на поверхню яких нанесена тонкодисперсна платина, насичена газоподібним воднем, на поверхні такого електрода в розчині протікає реакція
 .
.
Водневий електрод, в якому при температурі 25,150С активність Н+- іонів дорівнює 1 моль/л, тиск водню дорівнює 1 атм, називається нормальним водневим електродом (НВЕ). Стандартний потенціал нормального водневого електрода прийнято за нуль (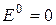 ). Тоді потенціал водневого електрода можна обчислити за формулою:
). Тоді потенціал водневого електрода можна обчислити за формулою:
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 5238; Нарушение авторских прав?; Мы поможем в написании вашей работы!