
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сорбційні (хроматографічні) методи аналізу
|
|
|
|
КУЛОНОМЕТРІЯ
Даний метод аналізу засновано на процесах відновлення або окислення (електролізі) речовини на електродах.
Якщо в результаті електролізу утворюється нерозчинна речовина (газ, тверда речовина) за реакціями
A+n + n ē = B (електровідновлення)
B-n - n ē = A (електроокислення),
то вимірявши витрачену кількість електрики і знаючи число електронів,які віддає чи приймає речовина під час електролізу та молярну масу речовиниможна обчислити масу речовини на електроді та її концентрацію в аналізуємому розчині. Такий спосіб аналізу називають прямою кулонометрією або електрогравіметрією.
Якщо визначаєма речовина не піддається електролізу, то в розчин додають допоміжну речовину, яка окислюється або відновлюється на електроді і продукти цих процесів хімічно реагують з визначаємою речовиною. Кількість електрики, витраченої на утворення продуктів електролізу допоміжної речовини, еквівалентна кількості визначаємої речовини і на цьому базуються розрахунки кількісного аналізу. Цей спосіб називають непрямою кулонометрією або кулонометричним титруванням.
Кулонометрію можна проводити при сталому потенціалі електроду (потенціостатична кулонометрія) або при сталій силі струму (гальваностатична або амперостатична кулонометрія).
Цим методом визначають мікрокількості різноманітних речовин (металів, органічних сполук тощо).
Сорбційні методи аналізу відносяться до гібридних методів, які поєднують в собі стадії розділення компонентів об,єкту та їх визначення за допомогою хімічних або фізико-хімічних методів. Стадія розділення компонентів заснована на вибірковому поглинанні (сорбції) газоподібних або розчинених у рідині речовин (сорбатів) твердими або рідкими поглиначами (сорбентами). Сорбція – процес зворотний і рівноважний. Видалення сорбату з сорбенту називається десорбцією.
Сорбентами можуть бути: тверді пористі гранульовані речовини; спеціаль-ний папір або тонкий шар тонкодисперсних твердих речовин; густі нелеткі рідини,нанесені тонким шаром на поверхню твердого інертного носія; орга-нічні розчинники, які не змішуються з водою.
Процес сорбції можна проводити в:
-динамічному режимі, коли через колонку з нерухомим шаром сорбенту (НФ - нерухома фаза) пропускають потік газоподібного або рідкого об,єкту аналізу (РФ – рухома фаза);
-статичному режимі, коли рідкий або газоподібний об,єкт аналізу знахо- диться деякий час в контакті з твердим сорбентом, внесеним в нього.
Процес сорбції може бути обумовленим різними причинами:
- хімічні реакції: іоного обміну (іонообмінна хроматографія); комплексо- утворення (комплексоутворювальна хроматографія); утворення осадів (осад- на хроматографія); окислення-відновлення (окисно-відновна хроматографія); різна розчинність речовин в розчинниках, які не змішуються (розподільна хроматографія);
- фізичні процеси: взаємодія локальних електричних зарядів часток сорба- ту і сорбенту (адсорбційна хроматографія); різний розмір молекул сорбатів і пор гелевого сорбенту (гель-проникна хроматографія або молекулярне сито).
Сорбція відбувається на активних центрах (функціональних групах) сорбен- ту. В любій хроматографічній системі відбувається зворотний перехід моле- кул сорбату з РФ в НФ
Арф ↔ Анф
Цей процес описується константою рівноваги (коефіцієнт рівноважного розподілу)


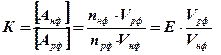
де nнф, nрф – кількість речовини в НР і РФ, Vрф, Vнф – об,єми РФ і НФ, відпо- відно; E - коефіцієнт ємності сорбенту (сорбційна ємність).
Сорбент має певну кількість функціональних груп на одиницю маси або об,єму. Значення Е та К залежать від умов проведення процесу, тому роз- ріняють повні, робочі, динамічні, статичні тощо їх значення. Сорбція припи- няється при повному заповнені функціональних груп сорбенту сорбатом. Це ілюструє ізотерма сорбції, яка описується рівнянням Лєнгмюра


 Cs c d
Cs c d

 b
b
 a Cm
a Cm
Рис. 19. Ізотерма сорбції
де Cm. Cs - відповідно, концентрація сорбата в РФ і НФ при встановленій сорбційній рівновазі; А і В – константи, які залежать від природи сорбата і сорбента.
При Cm << 1моль/л (відрізок ав на рис.19) в сорбенті велика кількість незаповнених функціональних груп, немає конкуренції між частками сорбату, на поверхні сорбенту утворюється мономолекулярний шар сорбату і Cs прямо пропорційна Cm. Рівняння Лєнгмюра для цього випадку має вигляд
Cs = А В Cm, оскільки 1- BCm ≈ 1. Після повного заповнення поверхні часток сорбенту мономолекулярним шаром сорбату починається утворення полі- молекулярних шарів сорбату на поверхні сорбенту і пропорційність між Cm і Cs порушується (відрізок вс на ізотермі). Це описується повним рівнянням ізотерми сорбції. Після повного заповнення функціональних груп сорбенту
(Cm >> 1 моль/л) сорбція припиняється (відрізок сd) і рівняння Лєнгмюра приймає вигляд Сs = A., оскільки 1 - BCm≈ BCm, а Сs =const.
Ефективність процесу сорбції залежить від природи сорбату і сорбенту. Різні сорбати поглинаються даним сорбентом в даних умовах з різною ефективністю. Це фіксує закон сорбційної спорідненості (закон М.С.Цвєта): вс і речовини в даних умовах по відношенню до даного сорбенту утворюють певний сорбційний ряд А>В>С>.... Кожний член цього ряду здатен витісню- вати з сорбенту наступний член ряду і сам може бути витісненим з нього попереднім членом ряду. Ця закономірність створює можливість керувати процесом сорбції і розділяти суміші речовин оскільки сорбати з високою сорбційною спорідненістю будуть міцніше утримуватись сорбентом і повільніше виходити з нього, ніж сорбати з низькою сорбційною спорідненістю.
Найчастіше використовують динамічний режим процесу сорбції. Його проводять такими способами:
- фронтальний: через сорбент безперервно з постійною швидкістю пропуска- кають потік суміші сорбатів. Речовини розподіляються в шарі сорбенту згід- но їх сорбцій ним спорідненостям. В результаті послідовного витіснення сор- батів один одним склад елюату, який виходить к сорбенту буде таким. В пер- ших порціях знаходиться чистий розчинник (носій). Далі в чистому вигляді отримують деяку кількість речовини з найнижчою сорбційною спорідненіс- тю. Потім виходять суміші сорбатів згідно їх сорбційних спорідненостей. На сорбенті концентрується речовина з найвищою сорбційною спорідненістю;
- витіснювальний: через сорбент пропускають порцію аналізуємої суміші речовин. Вони розміщуються в сорбенті зонами згідно їх сорбційної спорідненості. Потім через сорбент пропускають витіснювач - речовину, яка має більшу сорбційну спорідненість, ніж компоненти суміші. В результаті послідовного витіснення речовин одна одною отримуємо окремо кожний компонент суміші в чистому вигляді;
- елюентний: по техніці виконання є варіантом витіснювального способу, але зміщення сорбційної рівноваги досягають за рахунок великої кількості елюен та в порівнянні з кількістю сорбату, який витіснюється. З сорбенту послідов- но виходять суміші окремих сорбатів з елюентом. В цьому випадку необ,язко вою є більша сорбційна спорідненість елюенту.
Завдяки різній сорбційній спорідненості сорбати проходять шар сорбенту з різною швидкістю. Час перебування сорбату в шарі сорбенту (час утриман ня) також є характеристикою ефективності сорбції. Між Е , та часом утриман ня даного сорбату існує залежність
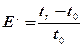

де tr, t0 – час утримання сорбату та час виходу з сорбенту речовини, що не взаємодіє з НР, відповідно.
Об,єм елюату, який проходить через сорбент від моменту вводу проби до моменту виходу сорбату з нього, називають об,ємом утримання Vr = tr V.
де V – об,ємна швидкість елюента.
Повна сорбційна рівновага досягається на певній довжині шару сорбенту, яку умовно називають висотою, яка еквівалентна теоретичній тарілці (ВЕТТ). Сорбати розміщуються в шарі сорбенту зонами певної висоти, тобто хроматографічна колонка представляє собою ряд дискретних вузьких зон (хроматографічних смуг), які не торкаються одна одної (внутрішня хроматограма). Рух РФ приводить до переносу частини сорбату з однієї “тарілки” на наступну і далі. При цьому в смузі відбувається новий розподіл сорбату.між НФ і РФ в результаті чого сорбат опиняється в декількох зонах смуги, при чому концентрація його в них буде неоднаковою. Графічне зображення розподілу сорбату в межах хроматографічної смуги називають хроматографічним піком, а внутрішньої хроматограми – хроматограмою проби (рис. 24).
Переміщення сорбату в смузі приводить до так званого розмивання (роз-ширення) хроматографічної смуги. Розмивання хроматографічної смуги мо-же бути спричинено: 1) різною швидкістю руху зон з різною концентрацією сорбату (термодинамічне розмивання); 2) дифузією речовин (дифузійне роз-мивання); 3) малою швидкістю процесів сорбції і десорбції (кінетичне
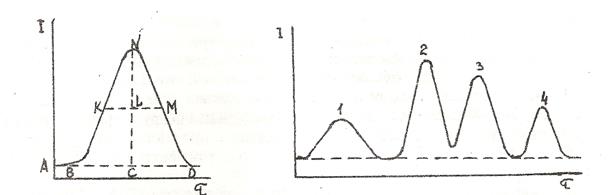
Рис. 20. Хроматографічний пік (а) і хроматограма суміші речовин(б)
А – точка старту (введення проби в колонку) BD-ширина піку;
CN - висота піку; KM – середня лінія піку (CL = LM),
I – параметр,пропорційний концентрації сорбату в елюаті.
розмивання); 4) нерівномірність руху потоку РФ в колонці (вихрова дифузія). Роз-мивання хроматографічних смуг приводить до викривлення ізотерми сорбції (випуклі, ввігнуті, складні) і несиметричності хроматографічних піків. Ці об-ставини служать джерелом похибок при проведенні кількісного хроматогра-фічного аналізу, тому створюють умови (концентрація речовин, швидкість потоку РФ, дисперсність сорбенту, температура та ін.), які виключають або зводять до мінімуму розмивання хроматографічних смуг.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 902; Нарушение авторских прав?; Мы поможем в написании вашей работы!