
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кондуктометрія
|
|
|
|
Даний метод засновано на залежності електричної провідності (електричного опору) розчину від концентрації електроліту в ньому. Схема методу наступна: за допомогою електродів, підключених до зовнішнього джерела змінного струму, в аналізуємому розчині електроліту створюється електричне поле. Під дією цього поля іони здійснюють коливально-поступальні рухи в напрямку поля. Швидкість руху іонів залежить від їх розмірів, заряду, розмірів сольватної оболонки навколо них, властивостей розчинника, присутності інших іонів, параметрів електричного поля. Для її характеристики користуються величиною рухомості іону λ0+- = υ0+- F, де υ0+- - абсолютна швидкість руху іону; F = 96500 Кл/моль, константа Фарадея. Аномально високу рухомість (табл.. 5) мають іони Н+ (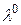 = 349,8 См · см2 · моль-1) та ОН- (
= 349,8 См · см2 · моль-1) та ОН- (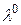 = 198,3 См · см2 · моль-1). Це пояснюється специфічним
= 198,3 См · см2 · моль-1). Це пояснюється специфічним
Таблиця 5. Гранична еквівалентна електрична провідність (рухомість)
іонів (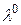 ) в водних розчинах при 25˚ С
) в водних розчинах при 25˚ С
| Катіон | 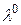
| Аніон | 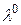
|
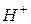
| 349,8 | 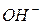
| 198,3 |
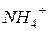
| 73,6 | 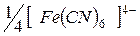
| 110,5 |
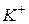
| 73,5 | 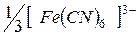
| 100,9 |
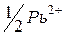
| 70,0 | 
| 85,0 |
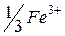
| 68,0 | 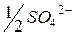
| 80,0 |
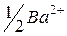
| 63,6 | 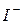
| 78,8 |
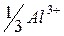
| 63,0 | 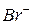
| 78,1 |
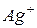
| 61,9 | 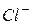
| 76,4 |
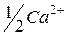
| 59,5 | 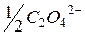
| 74,0 |
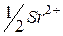
| 59,5 | 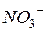
| 71,5 |
 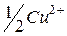 
| 56,6 | 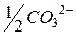
| 69,3 |
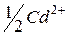
| 54,0 | 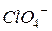
| 67,4 |
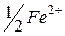
| 53,5 |  
| 65,0 |
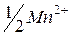
| 53,5 | 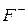
| 55,4 |
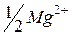
| 53,1 | 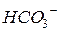
| 44,5 |
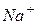
| 50,1 | 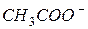
| 40,9 |
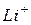
| 38,7 | 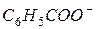
| 32,4 |
механізмом їх руху в розчині – «естафетним шляхом» (передача заряду від однієї молекули води до іншої). Рухомості інших іонів в водних розчинах відрізняються порівняно мало (в межах 30-70 одиниць). В зв’язку з досить близькими значеннями рухомостей іонів кондуктометричні вимірювання дають інформацію, головним чином, тільки про загальну концентрацію іонів в розчині. Мала селективність кондуктометричного методу є одним з його суттєвих обмежень.
В залежності від частоти струму зовнішнього джерела розрізняють низькочастотну і високочастотну кондуктометрію. Кондуктометричний метод, в якому використовують: струми низької частоты, засновано на вимірювані електричної провідності аналізуємих розчинів (або газів);- струми високої частоти (мегагерц та десятки мегагерц), засновано на вимірюванні двох струмів – струму провідності та струму зміщення. Перший з них, в основному, обумовлений переміщенням іонів в напрямку електрич-ного поля (застосовується в методі високочастотного титрування – ВЧТ), а другий – їх обернено-коливальним рухом (застосовується в методі діэлькометричного титрування).
Кондуктометричні методи класифікують в залежності від принципу вимірювання електричної провідності:
-пряма кондуктометрія, яка заснована на безпосередньому вімірюванні
електричної провідності розчину індивідуальної речовини, що аналізується;
-кондуктометричне і високочастотнетитрування (ВЧТ), яке засноване на вимірюванні електричної провідності, що змінюється в процесі титрування; при цьому про вміст речовини судять по зламу кривої титрування;
-хронокондуктометричне титрування, яке засновано на визначенні вмісту речовини по часу титрування при подачі розчину титранту з постійною швидкістю.
В н изькочастотній кондуктометрії в розчин електроліту поміщають два електроди однакової площі S, відстань між якими ι. Електроди підключа-ють до зовнішнього джерела змінного електричного струму низької частоти (50 Гц) і вимірюють величину електричної провідності або електричний опір розчину. Величини електричної провідності і електричного опору розчину залежать від властивостей іонів, їх концентрації, параметрів кондуктометричної ячейки і ці залежності описуються наступними формулами:
еквівалентна електрична провідність розчину 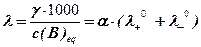 ,
,
де  λ0+, λ0- - рухомості катіону і аніону, відповідно, См· см2 · моль-1; α – ступінь дисоціації електроліту; c(B)eq – молярна концентрація еквіваленту аналізуємої речовини, моль/л. Питома електрична провідність розчину залежить від природи речовини і параметрів кондуктометричної ячейки γ = 1 / ρ =
λ0+, λ0- - рухомості катіону і аніону, відповідно, См· см2 · моль-1; α – ступінь дисоціації електроліту; c(B)eq – молярна концентрація еквіваленту аналізуємої речовини, моль/л. Питома електрична провідність розчину залежить від природи речовини і параметрів кондуктометричної ячейки γ = 1 / ρ =
= ι / S · R = G · ι / S. Поєднавши наведені вище закономірності отримуємо рівняння, за яким можна обчислити концентрацію розчину, скориставшись експериментальними даними (величини R, G, ι, S) і табульованими сталими (λ0+ і λ0-)
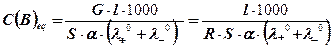
Кількісний аналіз проводять:
1) прямими методами,
- скориставшись наведеним вище рівнянням для розрахунку концентрації електроліту. При невідомому ступені дисоціації, можна скористатися зако--ном Оствальда 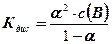 , де Кдис – константа дисоціації електроліту;
, де Кдис – константа дисоціації електроліту;
- використовуючи градуювальний графік, побудований в координатах
R - c(B) або G - c(B).
Кондуктометрія не є селективним методом оскільки всі кондуктометричні параметри – величини адитивні (сумарні). Тому прямими методами можна аналізувати тільки однокомпонентні об’єкти або визначати загальну кількість електролітів в розчині.
2) кондуктометричним титруванням. Титрування проводять, додаючи розчин реагенту порціями певного об’єму, і фіксують величини R (або G) післякожної порції. По отриманим даним будують криву титрування в координатах: R (або G) -- V( реагенту ). В точці еквівалентностіспостерігається злам кривої титрування (рис. 15). Форма кривої титрування залежить від рухомості іонів, які приймають участь в реакції. В кондуктометричному титруванні найчастіше використовують реакції: кислотно-основні; осадження, комплексоутворення і рідше окислення-відновлення. Реакції повинні відповідати наступним вимогам: велика константа рівноваги; практично миттєве встановлення хімічної рівноваги; велика швидкість реакції; відсутність побічних процесів; значна різниця в величинах рухомостей іонів, які приймають участь в реакції. При задоволені цих вимог використовують прямий спосіб титрування. В інших випадках можливо проводити аналіз способама титрування по залишку (зворотнє титрування) і по заміщенню.




 G G
G G

 а) б)
а) б)
т.е т.е т.е.




V(реагенту) V(реагенту)
Рис. 15. Криві титрування однокомпонентної (а) та
двокомпонентної систем (б); т.е. точка еквівалентності.
Електричну провідність розчинів визначають за допомогою кондуктометрів різноманітних конструкцій, вимірюючи електричний опір шару рідини, який знаходиться між двома паралельними електродами площею 1 см2 кожний при відстані між ними 1 см, які занурені в розчин, що аналізують.
В прямій кондуктометрії звичайно використовують ячейки з жорстко закріпленими електродами. В методах кондуктометричного титрування часто використовують так звані занурювальні електроди, які дозволяють проводити титрування в любих ємкостях, в яких можна розмістити електроди. Величина опору розчину, яка вимірюється експериментально, залежить не тільки від розміру електродів і відстані між ними, але і від їх форми і взаємного розташу-вання, об’єму розчину та інших факторів. Істинна електрична провідність розчину γіст пропорційна величині γексп, яка експериментально вимірена: γіст = k · γексп, де k - константа ячейки.
Константа ячейки дуже важлива характеристика і її знаходять експериментально по электричній провідності стандартних водних розчинів хлориду калию.
Низькочастотна кондуктометрія непридатна для аналізу агресивних середовищ (небезпека корозії електродів), емульсій, суспензій (небезпека забруднення електродів).
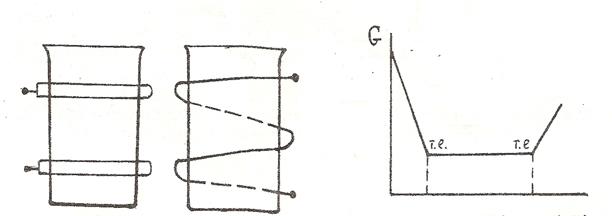
Високочастотна кондуктометрія заснована на використанні змінних струмів високої частоти (десятки мегагерц). Конструкція ячейок виключає безпосередній контакт електродів з розчином і це є одним з суттєвих переваг методу.. Ячейку з розчином, що аналізують, при високочастотному титруванні поміщають або між пластинками конденсатора (конденсаторна або ємкістна, або С – ячейка), або всередині індукційної катушки (індуктина або L ячейка) (рис.16).
В електричному полі високої частоти відсутній поступальний рух іонів в напрямку поля через їх велику інерційність. В такому полі іони деформуються (деформаційна поляризація) і обертаються навколо своєї осі (орієнтаційна поляризація ). Електрична провідність розчинів обумовлена наявністю в розчині струму провідності і струму зміщення. Електричні параметри розчинів залежать від багатьох факторів і ці залежності неможливо однозначно описати математичним рівнянням. Тому високочастотну
а б V (реагенту)
Рис.16. Ячейки для високочастотного Рис.17. Крива кондуктометричного
титрування: а – ємкістна титрування суміші сильної
(С- ячейка); б – індуктивна і слабкої кислот сильною
(L - ячейка) основою
кондуктометрію використовують тільки в титриметричному варіанті (високочастотне титрування, ВЧТ). Криві ВЧТ аналогічні кривим титрування в низькочастотній кондуктометрії, їх будують в координатах I - V( реагенту), де I - сила електричного струму в ланцюзі титратора(рис. 17). Промисловість випускає стандартні високочастотні титратори.
Основним достоїнством ВЧТ є можливість аналізу любих агресивних середовищ, оскільки електроди не мають контакту з розчином, що аналізується.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 4316; Нарушение авторских прав?; Мы поможем в написании вашей работы!