
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Природа хімічного звязку в координаційних сполуках. Метод валентних звязків
|
|
|
|
Номенклатура координаційних сполук. Пояснити на прикладах.
1) У назві комплексної сполуки першою вказується негативно заряджену частину - аніон, потім позитивну частину - катіон.
2) Назва комплексної частини починають з вказівки складу внутрішньої сфери. У внутрішній сфері насамперед називають ліганди - аніони, додаючи до їх латинській назві закінчення «о». Наприклад: Cl-- хлоро, CN-- ціано, SCN-- тіоціанат, NO3-- нітрати, SO32-- сульфіти, OH-- гідроксо і т. д. При цьому користуються термінами: для координованого аміаку - амміни, для води - аква, для оксиду вуглецю (II) - карбоніл.
3) Число монодентатно лігандів вказують грецькими числівниками: 1 - моно (часто не наводиться), 2 - ді, 3 - три, 4 - тетра, 5 - пента, 6 - гекса. Для полідентатними лігандів (наприклад, етилендіамін, оксалат) використовують біс-, трис-, тетракіс-і т. д.
4) Потім називають комплексоутворювач, використовуючи корінь його латинської назви та закінчення-ат, після чого римськими цифрами вказують (у дужках) ступінь окислення комплексообразователя.
5) Після позначення складу внутрішньої сфери називають зовнішню сферу.
6) У назві нейтральних комплексних частинок комплексоутворювач вказується у називному відмінку, а ступінь його не вказується, так як вона однозначно визначається, виходячи з електронейтральності комплексу.
Приклади:
K3 [Fe (CN) 6] - гексаціаноферрат (III) калію
(NH4) 2 [PtCl4 (OH) 2] - дигидроксотетрахлороплатинат (IV) амонію
[Сr (H2O) 3F3] - тріфторотріаквахром
[Сo (NH3) 3Cl (NO2) 2] - динитритохлоротриамминкобальт
[Pt (NH3) 4Cl2] Cl2 - хлорид діхлоротетрааммінплатіни (IV)
[Li (H2O) 4] NO3 - нітрат тетрааквалітія
У внутрішній сфері між комплексоутворювачем і лігандами існують ковалентні зв'язки, утворені в тому числі і за донорно-акцепторним механізмом. Для утворення таких зв'язків необхідно наявність вільних орбіталей у одних частинок (маються у комплексообразователя) і неподілених електронних пар в інших частинок (ліганди). Роль донора (постачальника електронів) грає ліганд, а акцептором, які приймають електрони, є комплексоутворювач. Донорно-акцепторні зв'язок виникає як результат перекривання вільних валентних орбіталей комплексообразователя із заповненими орбиталями донора.
Між зовнішньою і внутрішньою сферою існує іонний зв'язок. Наведемо приклад.
Електронна будова атома берилію:
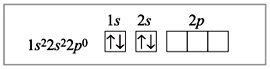
Електронна будова атома берилію в збудженому стані:
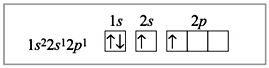
Електронна будова атома берилію в комплексном іоні [BeF4]2–:
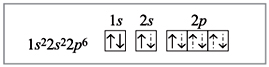
Пунктирними стрілками показані електрони фтору; два зв'язки з чотирьох утворені по донорно-акцепторним механізмом. В даному випадку атом Be є акцептором, а іони фтору - донорами, їх вільні електронні пари заповнюють гібрідізованние орбіталі (sp3-гібридизація).
 Теорія валентних зв'язків (метод валентних зв'язків, метод валентних схем, метод локалізованих електронних пар) - наближений Квантовохимический розрахунковий метод, заснований на уявленні про те, що кожна пара атомів у молекулі утримується разом за допомогою однієї або декількох загальних електронних пар.
Теорія валентних зв'язків (метод валентних зв'язків, метод валентних схем, метод локалізованих електронних пар) - наближений Квантовохимический розрахунковий метод, заснований на уявленні про те, що кожна пара атомів у молекулі утримується разом за допомогою однієї або декількох загальних електронних пар.
Теорія валентних зв'язків закладена в 1927 році В.Гайтлером і Ф.Лондоном на прикладі Квантовохімічне розрахунку молекули водню. В основі теорії валентних зв'язків лежить гіпотеза про те, що при утворенні молекули з атомів, останні в значній мірі зберігають свою електронну конфігурацію, а зв'язування атомів досягається в результаті обміну електронів між ними і спаровування спінів двох електронів, що знаходяться на атомних орбіталях вихідних атомів. Розрахунок Гайтлера - Лондона виявився досить значним за своїми результатами в розвитку квантової хімії. На підтвердження електронної октетное теорії (правило октету) Г.Льюіса було показано, що хімічний зв'язок в молекулі водню дійсно здійснюється парою електронів.
Електронна пара виявляється розмазаний по всьому простору молекули з різною щільністю, причому на лінії зв'язку між ядрами мається згущення електронної щільності в порівнянні з іншими областями простору. Це згущення електронної густини на лінії, що зв'язує ядра атомів, викликає стягуюче дію на ядра і, відповідно, призводить до утворення хімічного зв'язку. Енергія зв'язку визначається в основному обмінним інтегралом, величина якого суттєво залежить від ступеня перекривання атомних орбіталей атомів.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 775; Нарушение авторских прав?; Мы поможем в написании вашей работы!