
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Обчислення ентропії. Зміна ентропії у різних процесах
СТАТИСТИЧНИЙ ХАРАКТЕР ДРУГОГО ЗАКОНУ ТЕРМОДИНАМІКИ
Ентропія є мірою хаотичності розміщення частинок у речовині, або тіл у системі. Ентропія характеризує ту частину внутрішньої енергії, яка в роботу не може бути перетворена.
Вище було сказано, що самочинні процеси, які відбуваються в ізольованій системі, супроводжуються збільшенням ентропії. З другого боку, всі природні процеси відбуваються від менш ймовірного стану до більш ймовірного. З цього Больцман зробив висновок, що ентропія є мірою (функцією) ймовірності системи:
S = klnW,
де k = R/N – константа Больцмана; W – ймовірність системи.
Таким чином, з рівняння випливає, що зростання ентропії в самодовільних процесах відповідає переходу системи до стану з більшою ймовірністю. Тому другий закон термодинаміки можна розглядати як закон ймовірності для систем, що складаються з великої кількості молекул.В цьому полягає статистичний характер другого закону термодинаміки.
Для фазового перетворення ентропія визначається теплотою фазового перетворення і температурою:
∆S = S2 – S1 = Q/T.
Зміну ентропії при нагріванні одиниці маси речовини, що перебуває в твердому або рідкому етані, обчислюють за формулою:
ΔS = 2,303СпlgТ2/Т1,
де Сп – питома теплоємність речовини.
Приведемо приклади визначення зміни ентропії в процесах, здійснених 1 молем ідеального газу.
Адіабатний процес. Процес, який здійснюється без теплообміну, тоді
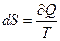 , S = const.
, S = const.
Таким чином, адіабатичний процес є ізоентропійним процесом (процесом з постійною ентропією).
Ізотермічний процес. Для ізотермічного процесу з ідеальним газом теплота дорівнює роботі (¶w = ¶ Q = РdV).
Використовуючи рівняння стану ідеального газу, одержимо:
¶ Q = RTdlnV; d S = RdlnV.
Якщо газ ізотермічно розширюється від об’єму V1до об’єму V2 або від тиску Р1 до тиску Р2то для розрахунку зміни ентропії використовують формули:
∆S = nRln(V2/V1) = nRln(Р1/Р2).
Ізохорний процес. Використовуючи теплоємність ізохорного процесу, одержимо вираз для зміни ентропії:
¶Q = СVdТ; dS = CVdТ/Т = CvdlnT.
Якщо початковому станові відповідає температура Т1 а кінцевому – Т2, то для розрахунку змін ентропії в ізохорному процесі з ідеальним газом використовують формули:
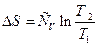 і
і 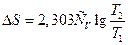 .
.
Ізобарний процес. У цьому процесі теплоту можна визначити, використовуючи теплоємність, внаслідок чого ентропія може бути знайдена за рівняннями:
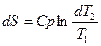 і
і 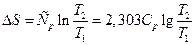 .
.
Якщо в системі, що складається з ідеального газу, одночасно змінюється кілька параметрів, тоді:
∆S = nСр ln (Т2/Т1) + nRln(Р1/Р2),
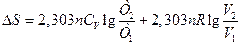 ;
; 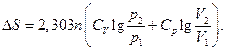
|
|
Дата добавления: 2015-05-23; Просмотров: 17670; Нарушение авторских прав?; Мы поможем в написании вашей работы!