
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хімічний потенціал
|
|
|
|
Термодинаміка хімічної рівноваги
Часткові похідні від інших термодинамічних потенціалів (при відповідних сталих) дорівнюють хімічному потенціалу компонента:

Таким чином, хімічний потенціал даної речовини рівний частинній похідній від будь-якого термодинамічного потенціалу даної фази до числа молів даної речовини при умові, що інші термодинамічні параметри і число молів решти речовин залишаються сталими.
Хімічний потенціал компонента залежить від температури, природи компонента та його вмісту в системі.
Для 1 моль ідеального газу за Т = const маємо:

Інтегруючи це рівняння, отримуємо:
G = RT ln p + const.
За стандартних умов const = G°, де G° – стандартна енергія Гіббса. Отже:
G = G0 + RT ln p.
Для компонента суміші ідеальних газів:
µі=µ0і+ RT lnрi,
де µ0і – стандартний хімічний потенціал, а рi – парціальний тиск компонента і.
Для ідеальних розчинів:
µі=µ0і+ RT lnсi,
де сi – концентрація компонента в розчині.
Для реальних розчинів концентрацію замінюють активністю:
µі=µ0і+ RT lnаi.
Поняття про активність було введено Льюїсом. Активність – це величина, підстановка якої замість концентрації у термодинамічні рівняння робить їх справедливими для реальних систем.
Активність дорівнює добутку концентрації на коефіцієнт активності:
ai = ci ∙ yi або ai = ci ∙ γi,
де уi і γi – відповідно молярний і моляльний коефіцієнти активності.
Хімічний потенціал є функцією, що визначає напрямок і межі довільного переходу даного компонента з однієї фази в іншу при відповідних перетвореннях (шляхом випаровування, розчинення, кристалізації і взаємодії).
Загальною умовою можливого перебігу довільного процесу є нерівність
 ,
,
а стану рівноваги відповідає рівність
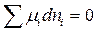 ,
,
де µ – хімічний потенціал; dn – зміна кількості молів речовини.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 3031; Нарушение авторских прав?; Мы поможем в написании вашей работы!