
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Приклади розв'язування задач
|
|
|
|
ЗАЛЕЖНІСТЬ КОНСТАНТИ РІВНОВАГИ ВІД ТЕМПЕРАТУРИ. РІВНЯННЯ ІЗОХОРИ ТА ІЗОБАРИ ХІМІЧНОЇ РЕАКЦІЇ
Константа рівноваги залежить від температури. Для ізобарних процесів цей зв'язок можна виразити рівнянням, яке має назву ізобари хімічної реакції
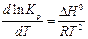
для ізохорних процесів у вигляді ізохори хімічної реакції
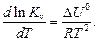
Зцих рівнянь можна зробити висновок, що для екзотермічної реакції (ΔН < 0) підвищення температури зменшує константу рівноваги, тобто зменшує вміст продуктів реакції у рівноважній суміші. Якщо реакція ендотермічна (ΔН > 0), то при підвищенні температури константа рівноваги збільшується, тобто вміст продуктів реакції у реакційній суміші збільшується. Таким чином, підвищення температури зміщує рівновагу в бік ендотермічної реакції.
Задача 1. Визначити сумарну зміну ентропії ΔS при нагріванні 1 моль води від температури плавлення до повного випаровування при температурі кипіння. Теплота плавлення льоду 335,2 Дж/г, теплота пароутворення води 2260 Дж/г питома теплоємність води 4,188 Дж/г∙град.
Розв'язування. Сумарна зміна ентропії ΔS рівна сумі зміни ентропії при плавленні ΔS1, зміні ентропії при нагріванні ΔS2 і ентропії ΔS3 – випаровування.
Визначаємо зміну ентропії при плавленні:
ΔS1 = L/T = (335,2∙18)/273 = 22,1 Дж/(моль·К).
Зміна ентропії при нагріванні:
ΔS2 = 2,303∙Сп lg (T2/T1) = 2,303∙4,188∙18∙lg(373/273) = 23,64 Дж/(моль·К).
Зміна ентропії при пароутворенні:
ΔS3 = (2260∙18)/273 = 109,06 Дж/(моль·К).
Тоді, ΔS = ΔS1 + ΔS2 + ΔS3 = 22,1 + 23,64 + 109,06 = 154,8 Дж/(моль·К).
Задача 2. Визначити зміну ентропії при розширенні 70 г азоту з 0,200 (тиск 506625 Па) до 0,056 м3 (тиск 101325 Па). Ср прийняти таким, що дорівнює 29,43 Дж/(моль·К).
Розв'язування. Зміну ентропії обчислюємо за рівнянням  попередньо обчисливши кількість молів азоту n і C V:
попередньо обчисливши кількість молів азоту n і C V:
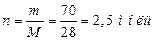 .
.
C V = CP – R = 29,43 – 8,3736 = 21,06 Дж.
Тоді, 
Відповідь: ΔS = 8,919 Дж/К.
Задача 3. Визначити стандартну спорідненість водню до кисню при 1000 К, якщо ступінь дисоціації водяної пари при цій температурі під тиском 1,0133·105 Па дорівнює 7·10-7.
Розв'язування. Стандартну енергію Гіббса знаходимо за формулою:
∆G0 = 2,303Δn RT lg1,0133·105 – 2,303RT lgKр = 2,303∙8,314·103∙1000(0,5 lg1,0133·105 – lg7·10-7) = 179,04 Дж/моль.
Відповідь: ∆G0 = 179,04 Дж/моль.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 1170; Нарушение авторских прав?; Мы поможем в написании вашей работы!