
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Інформаційна частина. Дослідження рівноваги оборотної хімічної реакції
|
|
|
|
Дослідження рівноваги оборотної хімічної реакції
ЛАБОРАТОРНА РОБОТА
Хімічні реакції поділяють на гомогенні та гетерогенні. Хімічна реакція, що протікає у межах однієї фази – гомогенна. Хімічна реакція, що протікає на межі поділу фаз – гетерогенна. Будь-яка оборотна хімічна реакція (гомогенна чи гетерогенна) може протікати самочинно до тих пір, поки в системі не буде досягнуто хімічної рівноваги між речовинами, що реагують. Умови хімічної рівноваги можуть бути визначені як з точки зору термодинаміки, так і з точки зору молекулярної кінетики.
Термодинамічна хімічна рівновага визначається співвідношенням концентрацій вихідних речовин та продуктів реакції при якому ентропія системи максимальна, а вільна енергія Гіббса – мінімальна.
Молекулярно-кінетична хімічна рівновага визначається, як такий стан, при якому швидкості прямої та зворотної реакцій рівні і склад системи при певних зовнішніх умовах не змінюється. Так, для оборотної хімічної реакції:
k1
а А (р) + в В (р) 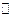 f F (р) + d D (р)
f F (р) + d D (р)
k2
швидкості прямої (u1) та зворотної (u2) реакцій рівні:
u1 = k1CAa CBb u2 = k2CF f CDd,
де k1 , k2 – константи швидкості прямої та зворотної реакцій відповідно; CA, CB, CF, CD – біжучі концентрації речовин А, В, F та D.
В умовах рівноваги (u1 = u2):
k1 [ CA ] a [ CB ] b = k2 [ CF ] f [ CD ] d
 ,
,
де [ CA ],[ CB ],[ CF ],[ CD ] – рівноважні концентрації речовин А, В, F та D; Кс – константа рівноваги, виражена через рівноважні концентрації учасників реакції.
Залежність константи рівноваги від температури описується рівнянням Вант-Гоффа:
 ,
,
де D Н – зміна ентальпії системи; R – універсальна газова стала; Т – температура. Використовуючи наведене рівняння в інтегральній формі:  за експериментальною залежністю константи рівноваги від температури можна визначити тепловий ефект оборотної реакції. З цією метою можна використати графічний метод визначення D Н, який полягає у побудові лінійної залежності ln Kc – 1/T (не менше трьох точок) і визначенні її кутового коефіцієнта (tga):
за експериментальною залежністю константи рівноваги від температури можна визначити тепловий ефект оборотної реакції. З цією метою можна використати графічний метод визначення D Н, який полягає у побудові лінійної залежності ln Kc – 1/T (не менше трьох точок) і визначенні її кутового коефіцієнта (tga):
 .
.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 410; Нарушение авторских прав?; Мы поможем в написании вашей работы!