
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон дії мас та константи рівноваги
|
|
|
|
Експериментально встановлено, що в багатьох випадках швидкість хімічних реакцій прямо пропорційна концентрації реагуючих речовин. У 1865 році М. М. Бекетов опублікував дослідження в області хімічної активності металів, у яких фактично було сформульовано закон дії мас, кількісне формулювання і кінетичне виведення якого були подані 1867 року Гульдбергом і Вааге. Вони зазначили, що стан рівноваги є динамічним станом, а не статичним, тобто стан рівноваги настає не від того, що всі хімічні реакції зупинились, а тому що швидкість прямої і зворотної реакції стають рівними.
Термодинамічні ознаки рівноваги:
1) незалежність стану рівноваги від того, з якого боку вона досягнута (тобто, від того, проходила реакція зліва направо чи справа наліво);
2) мінімальний запас енергії у стані рівноваги і максимальна ентропія.
Для оборотної газової реакції у загальному вигляді:
ν1А1 + ν2А2  ν3А3 + ν4А4
ν3А3 + ν4А4
закон дії мас запишеться через константу швидкості реакції:

де Кp(Т) – величина, яка залежить тільки від температури, не залежить від загального тиску та парціальних тисків і називається константою рівноваги.
Якщо концентрації реагуючих речовин виражають в молях на одиницю об'єму (С i) або в молярних долях (x i), то константу рівноваги виражають через ці величини:


Знайдемо зв'язок між Кр і Кс. У відповідності з рівнянням стану ідеального газу рi = niRT/Vi = ciRT.
Підставивши значення рi у рівняння для Кр, одержуємо:

де ∆ν = ν3 +ν4 –ν1 –ν2.
Отже,
Кр = Кс(RT)Δν
Тепер знайдемо зв'язок між Кх і Кс.
рі = рзаг∙хі,
де рзаг – загальний тиск і рі = cіR T.
Звідси:
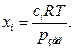
Підставимо значення х у рівняння для Кх:


Якщо ∆v = 0, то Кр = Кс = Кх.
Для гетерогенних реакцій, в яких конденсовані фази є індивідуальними речовинами, в рівняння константи хімічної рівноваги входять парціальні тиски (концентрації) тільки газоподібних компонентів. Концентрації твердих або рідких речовин сталі і можуть бути включені до константи рівноваги.
Всі наведені рівняння дійсні тільки для хімічних реакцій в ідеальному газі або розчині. Для реальних систем константу рівноваги виражають через активності і називають термодинамічною константою рівноваги:

Кр, Кс, Кх – концентраційні константи рівноваги. Ка – константа хімічної рівноваги, що характеризує ступінь повноти реакції. Залежить лише від температури і не залежить від початкових концентрацій реагуючих речовин, оскільки від них залежать константи швидкостей прямої і зворотної реакцій.
З рівнянь констант рівноваги випливає, що в умовах рівноваги концентрації усіх реагентів, пов’язані одна з одною і зміна однієї з них викликає зміну іншої, завдяки чому співвідношення між ними, тобто константа рівноваги, лишається сталою при даній температурі.
Константа рівноваги є кількісною характеристикою зміщення рівноваги у системі. Якщо К > 1, то швидше відбувається пряма реакція, і рівновага зміщена вправо, якщо К < 1, то швидше відбувається зворотна реакція і рівновага зміщена вліво і, якщо К = 0, то реакція не відбувається.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 1945; Нарушение авторских прав?; Мы поможем в написании вашей работы!