
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Інформаційна частина
|
|
|
|
Методом потенціометричного титрування
Визначення константи дисоціації оцтової кислоти
ЛАБОРАТОРНА РОБОТА
САМОСТІЙНА РОБОТА НА ЗАНЯТТІ
ІІІ. Розв’язати задачі
ІІ. Дати письмові відповіді на контрольні запитання
І. Засвоїти основний матеріал навчальної програми
ЗАВДАННЯ ДЛЯ САМОСТІЙНОЇ ПОЗААУДИТОРНОЇ РОБОТИ
1. Класифікація електродів та гальванічних елементів. Напруга гальванічних елементів. Методи вимірювання напруги гальванічних елементів.
2. Потенціометрія. Загальна характеристика методу, етапи потенціометрії. Області використання потенціометрії у фізичній хімії.
3. Застосування методу потенціометрії для визначення фізико-хімічних величин: визначення термодинамічних характеристик електро-хімічних реакцій (зміни енергії Гіббса, константи рівноваги, зміни ентропії і теплового ефекту), визначення коефіцієнту активості електролітів, константи дисоціації слабких електролітів, йонних добутків розчинників.
4. Нерівноважні електродні процеси. Полярографія.
1. Які фізико-хімічні характеристики можна визначити методом прямої потенціометрії і потенціометричного титрування?
2. Привести криві потенціометричного титрування і пояснити їх хід.
3. Накреслити графік потенціометричного титрування суміші соляної й оцтової кислот лугом (з потенціалом індикаторного електрода по осі ординат) і електричну схему установки. Які електроди можна при цьому застосовувати в якості індикаторних?
4. Дати загальну характеристику полярографічного методу аналізу.
5. Особливості проведення якісного і кількісного полярографічного методу аналізу.
1. Розрахувати ЕРС концентраційного гальванічного елемента, що складається з водневих електродів, заповнених 1 М розчинами НCl і NaOH, в яких коефіцієнти активності відповідно становлять 0,809 і 0,678.
2. Для водневого концентраційного гальванічного елемента виміряна ЕРС становить 0,373 В. Знайти рН шлункового соку, в якому занурено один водневий електрод, якщо другий такий же електрод поміщений у пробу крові з рН = 7,4.
3. Знайти рН та рОН шлункового соку, яким заповнено водневий електрод, що з'єднаний у гальванічний елемент з насиченим каломельним електродом при 20 °С, ЕРС цього елемента 0,195 В, а потенціал каломельного електроду дорівнює 0,247 В.
1. Виконання тестових завдань (перевірка домашньої самопідготовки).
2. Виконання лабораторної роботи.
3. Обговорення та математична обробка експериментальних результатів.
4. Обговорення висновків та оформлення протоколу (залік лабораторної роботи).
Метод потенціометричного титрування успішно використовують для визначення констант дисоціації слабких кислот. Процес дисоціації слабкої кислоти, наприклад оцтової, можна представити наступним рівнянням:
СН3СООН 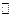 СН3СОО– + Н+.
СН3СОО– + Н+.
Згідно закону дії мас, константу дисоціації можна записати в вигляді рівняння:
Кд = [СН3СОО–][Н+]/[СН3СООН], (7.1)
де [СН3СОО–] – рівноважна концентрація ацетат-йонів у водному розчині; [Н+] – рівноважна концентрація йонів Гідрогену; [СН3СООН] – рівноважна концентрація молекул недисоційованої кислоти.
З рівняння (7.1) концентрація йонів Гідрогену виражається наступним рівнянням:
[Н+] = Кд [СН3СООН]/[СН3СОО–] (7.2)
або у логарифмічній формі
рН = рКд – lg([СН3СООН]/[СН3СОО–]), (7.3)
де pH = –lg[H+]; рКд = –lg Кд.
У процесі титрування СН3СООН лугом, наприклад NaOH, утворюється повністю дисоційована сіль – СН3СООNa. Таким чином, в результаті титрування утворюється буферна суміш СН3СООН + СН3СООNa. Для слабкої оцтової кислоти (рКд = 4,75) можна прийняти, що в ході титрування концентрація недисоційованих молекул рівна загальній концентрації невідтитрованої кислоти:
[СН3СООН] = (C0V0 – C1V1)/(V0 + V1), (7.4)
де C0 – концентрація оцтової кислоти в аліквоті, відібраній для титрування; V0 – об’єм аліквоти оцтової кислоти; C1 – концентрація титранту (NaOH); V1 – об’єм прилитого титранту.
Враховуючи, що СН3СООNa повністю дисоційований електроліт, концентрація ацетат-йонів в результаті його дисоціації значно перевищує рівноважну концентрацію СН3СОО–, що утворюється за рахунок дисоціації оцтової кислоти. Виходячи з цього, в першому наближенні можна припустити, що концентрація ацетат-йонів рівна концентрації натрій ацетату, утвореного в результаті титрування:
[СН3СОО–] = C1V1/(V0 + V1). (7.5)
Комбінуючи вирази (7.4) і (7.5) рівняння (7.3) можна записати наступним чином:
рН = рКд – lg[(C0V0 – C1V1)/C1V1]. (7.6)
Рівняння (7.6) лежить в основі методу визначення величини константи дисоціації з допомогою потенціометричного титрування. Виміривши рН розчину після приливання певного об’єму титранту (V1) до розчину оцтової кислоти, з допомогою рівняння (7.6) можна обчислити значення Кд (значення C0, V0 та С1 – задаються).
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 453; Нарушение авторских прав?; Мы поможем в написании вашей работы!