
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ферментний каталіз
|
|
|
|
КИСЛОТНО-ОСНОВНИЙ КАТАЛІЗ
Кислотно-основний каталіз включає:
· специфічний кислотно-основний каталіз (каталіз йонами гідроксонію і гідроксиду);
· загальний кислотно-основний каталіз (каталізатори – кислоти і основи Бренстеда);
· електрофільно-нуклеофільний каталіз (каталізатори – кислоти і основи Льюїса).
Механізм кислотно-основного каталізу полягає у протолітичній взаємодії між каталізатором і реагуючою речовиною, внаслідок чого утворюється нестійка проміжна сполука, яка потім розкладається на продукт реакції і каталізатор. Прикладами кислотно-основного каталізу можуть бути реакції гідролізу естерів, етерифікації, гідролізу полісахаридів, ізомеризації, галогенування, конденсації та ін.
Автокаталіз – процес каталітичного прискорення хімічної реакції одним з її продуктів. Прикладом є реакція гідролізу складних естерів, яка каталізується йонами водню. Кислота, яка утворюється при гідролізі, дисоціює з утворенням протонів, які прискорюють реакцію гідролізу. Особливістю автокаталітичної реакції є те, що вона відбувається зі сталим зростанням концентрації каталізатора. Тому в початковий період реакції швидкість її зростає, а на подальших стадіях внаслідок зменшення концентрації реагентів швидкість зменшується.
Усі хімічні процеси за умов фізіологічного середовища організму (гідроліз, протоліз, фосфорилювання, комплексоутворення, окисно-відновні реакції) можуть відбуватися тільки за участю каталізаторів, які називають ферментами, або ензимами.
Ферменти – це речовини білкової природи, які виробляються клітинами живих організмів і значно збільшують швидкість біохімічних процесів.
Перші відомості про речовини, що прискорюють швидкість реакції спиртового бродіння цукрів, з'явились ще на початку XVII ст. Голландський вчений В. Гельмонт запропонував називати їх ферментами. Нині відомо декілька тисяч таких речовин, з яких дуже багато виділено в чистому кристалічному вигляді. Вважають, що в клітині міститься близько 10 тис. молекул різних ферментів, які прискорюють понад 2 тис. реакцій. Четверта частина всіх вивчених ферментів містять йони різних металів і тому їх називають металоферментами.
Ферменти, як і неорганічні каталізатори, підлягають загальним законам каталізу і характеризуються рядом подібних ознак, тобто вони:
· каталізують тільки ті реакції, які є енергетично можливими;
· зменшують енергію активації реакцій, тим самим значно прискорюючи їх;
· не витрачаються в процесі біохімічної реакції.
Проте ферменти характеризуються й особливими ознаками, які дають можливість відрізнити їх від звичайних неорганічних каталізаторів. Ці відмінності пов'язані з особливостями будови ферментів.
Основою ферментних каталізаторів є поліпептидні ланцюги, структурними одиницями яких є амінокислоти з різними замісниками. До складу ферментів входять і катіони металів, здатні утворювати донорно-акцепторні центри, які прискорюють реакції з переносом електрона. Поліпептидні ланцюги мають велику масу і розміри, які набагато перевищують за розміром молекули субстратів та продуктів. Тому виникає здатність ферментів до адсорбції. Гнучкість поліпептидних ланцюгів і можливість до утворення водневих зв'язків і S-S зв'язків веде до формування просторових структур, які мають порожнини різної геометрії – все це надає можливість для чисельних зв'язків.
Ферментний каталіз має дві характерні особливості:
1. Висока активність, яка на декілька порядків вища за активність неорганічних каталізаторів. Так, константа швидкості реакції розкладення пероксиду водню, яку каталізують йони Fe2+, складає 56 с-1, константа швидкості цієї ж реакції, яку каталізує фермент каталаза, дорівнює 3,5∙107, тобто реакція в присутності фермента протікає в міліон раз швидше (енергії активації процесів відповідно 42 і 7,1 кДж/моль).
2. Висока специфічність. Наприклад, амілаза каталізує гідроліз крохмалю, який являє собою ланцюг однакових глюкозних фрагментів, але не каталізує гідроліз сахарози, молекула якої складена з глюкозного і фруктозного фрагментів. Уреаза, яка каталізує гідроліз сечовини, є неактивною при гідролізі інших амідів, які не відрізняються від сечовини за реакційною здатністю.
У відповідності до прийнятих нині уявлень, субстрат S і фермент F знаходяться в рівновазі з фермент-субстратним комплексом FS, який, дуже швидко утворюється та повільно розкладається на продукт реакції Р з вивільненням вільного ферменту:
F + S↔ FS®F + P.
 Дослідження залежності швидкості ферментної реакції від концентрації субстрату при сталій концентрації ферменту показали, що при збільшенні концентрації субстрату швидкість реакції спочатку збільшується, а потім стабілізується (рис). Залежність швидкості реакції від концентрації субстрату підкоряється наступному рівнянню:
Дослідження залежності швидкості ферментної реакції від концентрації субстрату при сталій концентрації ферменту показали, що при збільшенні концентрації субстрату швидкість реакції спочатку збільшується, а потім стабілізується (рис). Залежність швидкості реакції від концентрації субстрату підкоряється наступному рівнянню:
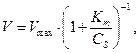
де Кm – константа Міхаеліса, яка чисельно дорівнює концентрації субстрату при V = 1/2 Vmax.
Константа Міхаеліса є мірою спорідненості між субстратом і ферментом: чим менше Кm, тим більше їх здатність до утворення фермент-субстратного комплексу.
Характерна особливість дії ферментів є висока чутливість активності ферментів до зовнішніх умов – рН середовища і температури. Ферменти активні лише в достатньо вузькому інтервалі рН і температури, причому для ферментів характерна наявність в цьому інтервалі максимуму активності при деякому оптимальному значенні рН або температури; по обидві сторони від цього значення активність ферментів швидко знижується.
Широко використовують у фармацевтичній практиці ферментні препарати: пепсин при гастриті, лідазу при опіках, контрактурах суглобів, препарати лізоциму для лікування інфекційних захворювань, стрептокіназу, стрептазу для лікування тромбозу та ін. Існують також препарати, до складу яких входять декілька ферментів: фестал, ензістал, лізим, солізим, призначені для комплексного лізису білків, вуглеводів та жирів.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 2024; Нарушение авторских прав?; Мы поможем в написании вашей работы!