
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Інформаційна частина. Тіосульфатної кислоти
|
|
|
|
Тіосульфатної кислоти
Визначення температурного коефіцієнту та енергії активації розкладу
ЛАБОРАТОРНА РОБОТА
Самостійна робота на занятті
1. Виконання тестових завдань (перевірка домашньої самопідготовки).
2. Аналіз та обговорення основних питань теми, корекція вихідного рівня знань.
3. Виконання лабораторної роботи.
4. Обговорення та математична обробка експериментальних результатів.
5. Обговорення висновків та оформлення протоколу (залік лабораторної роботи).
Зі збільшенням температури швидкості хімічних реакцій у значній мірі зростає (зростає константа швидкості реакції). Як розглядалося вище, у більшості випадків при підвищенні температури на 10°С швидкість реакції зростає в 2-4 рази (правило Вант-Гоффа):
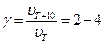 , (1)
, (1)
де g - температурний коефіцієнт швидкості реакції.
При збільшенні температури від Т1 до Т2 (Т1 – Т2=10n, де n=1,2,3...) правило Вант-Гоффа можна представити наступним виразом:
 . (2)
. (2)
Швидкість реакції в першому наближенні можна представити:
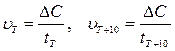 , (3)
, (3)
де DС – фіксована кількість речовини, що реагує (утворюється) протягом часу  при температурі Т та протягом часу
при температурі Т та протягом часу  при температурі Т+10.
при температурі Т+10.
З урахуванням (3) величину температурного коефіцієнту можна представити:
 , (4)
, (4)
а для інтервалу температур Т1¸Т2 (Т1- Т2=10n, де n=1,2,3...):
 . (5)
. (5)
На практиці для визначення величини температурного коефіцієнту реакції зростання є рівняння (4). Використовуючи величину температурного коефіцієнту, експериментально визначеного в інтервалі температур Т1¸Т2 можна обчислити величину енергії активації, яка є важливою кінетичною та термодинамічною характеристикою реакції:
 , (6)
, (6)
де R – універсальна газова стала.
В даній лабораторній роботі досліджується вплив температури на протікання реакції розкладу тіосульфатної кислоти: H2S2O3®H2SO3+S. Згідно з літературними даними, енергія активації цієї реакції становить 65,96 кДж/моль, температурний коефіцієнт – 2,44. Мета лабораторної роботи – визначити температурний коефіцієнт та енергію активації реакції та перевірити правомірність виведених формул (4) та (5), зіставивши експериментальні дані з літературними.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 592; Нарушение авторских прав?; Мы поможем в написании вашей работы!