
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Приклади розв’язування задач. Реакції при гетерогенному каталізі проходять на поверхні поділу фаз, утвореної каталізатором і реагуючими речовинами
|
|
|
|
ГЕТЕРОГЕННИЙ КАТАЛІЗ
Реакції при гетерогенному каталізі проходять на поверхні поділу фаз, утвореної каталізатором і реагуючими речовинами. Механізм гетерогенно-каталітичних процесів набагато складніший за механізм гомогенних каталітичних процесів. В кожній гетерогенно-каталітичній реакції можна виділити не менше шести стадій:
1. Дифузія вихідних речовин до поверхні каталізатора.
2. Адсорбція вихідних речовин на активних центрах за рахунок хімічних і електростатичних сил.
3. Активація адсорбованих молекул з утворенням активованого комплексу (необхідна для цього енергія є істинною енергією активації процесу).
4. Розпад активованого комплексу з утворенням адсорбованих продуктів реакції.
5. Десорбція продуктів з поверхні каталізатора.
6. Дифузія продуктів від поверхні каталізатора в глибину фази.
Адсорбцією називають процес самодовільного підвищення концентрації речовини на поверхні поділу фаз. Адсорбція реагуючої речовини на каталізаторі може здійснюватися за рахунок сил міжмолекулярної взаємодії (фізична адсорбція). Необхідною стадією каталітичної реакції є хімічна адсорбція або хемосорбція хоча б одного з реагентів, коли між адсорбованою речовиною і каталізатором виникає хімічна взаємодія.
Специфічною особливістю гетерокаталітичних процесів є здатність каталізатора до промотування і отруєння.
Промотування – збільшення активності каталізатора в присутності речовин, які самі не є каталізаторами цього процесу (промоторів). Наприклад, для реакції
СО+ Н2О ® СН4 + Н2О,
яка каталізується металічним нікелем, введення до каталізатору невеликої домішки церію веде до різкого зростання активності каталізатора.
Задача 1. У скільки разів збільшиться швидкість реакції при підвищенні температури від 500 до 580 К, якщо температурний коефіцієнт швидкості реакції дорівнює 3?
Розв’язування.Зміну швидкості реакції знаходимо за рівнянням:

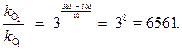
Відповідь: При підвищенні температури від 500 до 580 К швидкість реакції збільшиться 6561 раз.
Задача 2. Обчислити за правилом Вант-Гоффа, на скільки треба підняти температуру, щоб швидкість реакції зросла в 50 раз, якщо температурний коефіцієнт швидкості дорівнює 3.
Розв’язування. Використовуємо рівняння:

Після логарифмування одержимо:

Підставляємо відповідні значення:
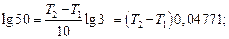
T2 – T1 = lg50/0,04771 = 1,6989/0,04771= 35,61 0С.
Таким чином, щоб швидкість реакції зросла в 50 раз, необхідно підвищити температуру приблизно на 35 0С.
Задача 3. При збільшенні температури на 50 °С швидкість реакції збільшилася у 1024 рази. Обчислити температурний коефіцієнт швидкості.
Розв’язування. Підставимо значення у рівняння Вант-Гоффа:


Відповідь: γ = 4,00.
Задача 4. Для однієї з реакцій експериментально визначено дві константи швидкості: при 716 К – 0,0087 с-1, а при 781 К – 0,1059 с-1. Обчислити значення енергії активації цієї реакції.
Розв’язування. Значення енергії активації визначаємо за рівнянням:
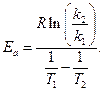
Підставивши відповідні значення одержимо:
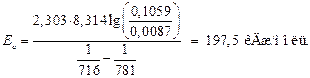
Відповідь: Енергія активації становить 197,5 кДж/моль.
Задача 5. При температурі T 1 = 25 °С константа швидкості реакції становить К1 = 9,67, a при температурі T2 = 40 °С константа швидкості реакції збільшується до К2 = 72,8. Визначити температурний коефіцієнт швидкості реакції.
Розв’язування. Запишемо правило Вант-Гоффа відносно температурного коефіцієнту швидкості реакції γ:
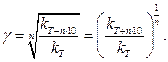
Підставляємо числові значення (з врахуванням того, що n = (T2 – T1)/10 =
= (40 – 25)/10 = 1,5), тоді:

Відповідь: γ = 3,84.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 2072; Нарушение авторских прав?; Мы поможем в написании вашей работы!