
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тверді речовини. Кристалічний стан речовин
Розрізняють кристалічний та аморфний стан твердих речовин.
Кристалічний стан речовин характеризується впорядкованим розміщенням частинок речовини в усьому об'ємі кристалу. В аморфному стані впорядковане розташування частинок зустрічається лише на дуже маленьких ділянках, а не в усьому об'ємі.
Речовини у кристалічному стані мають сталу температуру плавлення. А речовини в аморфному стані за нагрівання розм'якшуються поступово, тобто не за сталої температури, а у деякому температурному інтервалі.
Аморфний стан є характерним для силікатного скла, твердих смол. Деякі речовини можуть знаходитись як у кристалічному, так і в аморфному стані. Наприклад, силіцій (IV) оксид SiO2 зустрічається в природі у вигляді кристалів кварцу і в аморфному стані у вигляді мінералу кремінь.
Завдяки високому ступеню упорядкованості частинок кристалічний стан є енергетично більш стійким, ніж аморфний. Тому можливий перехід речовин з аморфного у кристалічний стан, що супроводжується виділенням енергії. Але цей процес відбувається дуже повільно через в'язкість системи.
У речовин в кристалічному стані певні точки простору, де знаходяться частинки речовини, мають назву вузлів кристалічної решітки. В залежності від природи частинок, що містяться у вузлах кристалічної решітки, та характеру взаємодії між ними розрізняють такі основні типи кристалічних решіток: атомні, молекулярні, йонні і металічні.
У вузлах атомних решіток містяться атоми, зв'язані міцними ковалентними зв'язками. Речовини з атомними решітками характеризуються високими температурами плавлення, великою твердістю і практично не розчинні у жодному з розчинників, неелектропровідні та погано проводять тепло. Ковалентний зв'язок між атомами не допускає взаємного зміщення атомів без руйнування решітки. Тому для кристалів з атомною решіткою характерна крихкість. До речовин з атомними решітками належать алмаз, кремній, бор, кварц SiO2, бор нітрид BN, карборунд SiС тощо.
У вузлах молекулярних решіток розміщені молекули, зв'язані між собою міжмолекулярною взаємодією. Оскільки міжмолекулярна взаємодія значно слабкіша за ковалентний зв'язок, то речовини з молекулярними решітками мають невелику твердість, леткі, легкоплавкі. Особливо низькі температури плавлення у тих речовин, молекули яких неполярні, тому що між ними існує тільки дисперсійна взаємодія. Речовини з молекулярними решітками не проводять електричний струм, розчинні, але їх розчинність залежить від природи молекул, з яких вони побудовані. Якщо решітка побудована з неполярних молекул, то речовина розчиняється у неполярних розчинниках. Якщо у вузлах решітки містяться полярні молекули, то речовина розчиняється у полярних розчинниках.
Молекулярні решітки утворюють такі речовини: більшість органічних сполук, HF, НСІ, Н2О, H2S, NH3, CO2, H2, O2, Р4, Сl2, І2, Не, Ne, Ar тощо.
У вузлах йонних решіток розміщені йони протилежного знаку, зв'язані силами електростатичного притягання. До сполук з йонними решітками належить більшість солей та оксиди активних металів, наприклад, NaCl, КІ, NH4NO3, СаO. Характерними властивостями більшості таких сполук є їх розчинність у полярних розчинниках, електропровідність іх розчинів та розплавів.
У вузлах металічних решіток містяться атоми та катіони металів, між якими вільно рухаються валентні електрони і забезпечують зв'язок між катіонами металу. Такий нелокалізований зв'язок в кристалах металів називається металічним.
Свобода руху електронів в кристалах металів обумовлює високу тепло- та електропровідність металів. Через те, що валентні електрони не закріплені за однією або іншою парою атомів, в металах можливе значне зміщення атомів без руйнування зв'язку. Тому для металів характерна пластичність, здатність до деформації.
4. КЛАСИ НЕОРГАНІЧНИХ СПОЛУК
Найважливішими класами неорганічних сполук є оксиди, гідроксиди (продукти приєднання води до оксидів), солі.
Оксиди - це сполуки атомів елемента з атомами оксигену. Валентність оксигену в оксидах дорівнює двом, а ступінь окиснення "-2". Валентність елемента та його ступінь окиснення в оксидах чисельно збігаються. Якщо відомий ступінь окиснення елемента "+n", то формулу оксиду 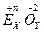 складають, враховуючи, що алгебраїчна сума ступенів окиснення усіх атомів у складі оксиду дорівнює нулю: х·(+n) + у·(–2) =0.
складають, враховуючи, що алгебраїчна сума ступенів окиснення усіх атомів у складі оксиду дорівнює нулю: х·(+n) + у·(–2) =0.
Назви оксидів. Назву оксиду складають з двох слів: перше є назвою елемента, а друге – „оксид”. Якщо елемент може виявляти різну валентність, отже, і різні ступені окиснення, то після назви елемента римською цифрою вказують її значення.
Хімічний характер оксидів визначається їх відношенням до кислот та основ. За хімічним характером оксиди поділяють на несолетворні та солетворні. До несолетворних оксидів, які не беруть участь в реакціях з утворенням солей, належать такі оксиди деяких неметалів: CO, SiO,NO,N2O. Солетворні оксиди, які здатні утворювати солі, в свою чергу поділяють на основні, амфотерні та кислотні.
Основні оксиди. До основних оксидів належать оксиди тільки металів з валентністю І та II (із ступенем окиснення "+1" та "+2"). Гідроксиди основних оксидів є основами. Основа Me(OH)n складається з атома металу та гідроксид-груп ОН, число яких дорівнює валентності металу.
| Оксид | Назва оксиду | Гідроксид – основа | Залишки основи |

| Калій оксид | 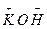
| K+ |
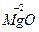
| Магній оксид | 
| Mg+2, MgOH+ |
Залишок основи - це частинка, яка залишається після відщеплення всіх або частини груп ОН від основи. Залишок основи має позитивний заряд, який дорівнює числу відщеплених груп ОН. Число залишків основи відповідає числу груп ОН в її складі.
Кислотні оксиди. До кислотних оксидів належать оксиди металів з валентністю V, VІ, VІІ та оксиди неметалів незалежно від іх валентності за винятком несолетворних оксидів (CO, SіО, N2O, NO). Гідроксиди кислотних оксидів є кислотами. Формулу оксигенвмісної кислоти можна скласти додаючи воду до кислотного оксиду.
| Оксид | Назва оксиду | Гідроксид – кислота | Кислотні залишки |
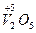
| Ванадій (V) оксид | 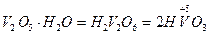
| 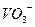
|
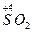
| Сульфур (IV) оксид | 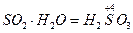
| 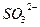 , , 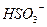
|
Кислоти складаються з атомів гідрогену та кислотного залишку.
Кислотний залишок - це частинка, яка залишається після відщеплення від молекули кислоти всіх або частини атомів гідрогену. Число кислотних залишків дорівнює числу атомів гідрогену у складі молекули кислоти, які здатні заміщуватись на атоми металу. Кислотний залишок має негативний заряд, який дорівнює числу відщеплених атомів гідрогену.
Амфотерні оксиди. До амфотерних оксидів належать оксиди тільки металів з валентністю III, ІV та оксиди деяких металів з валентністю II, а саме: BeO, ZnO, SпО, РbO. Гідроксиди амфотерних оксидів виявляють властивості як основ, так і кислот.
| Оксид | Назва оксиду | Гідроксид |
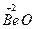
| Берилій оксид | 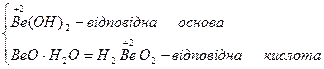
|
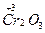
| Хром (ΙΙΙ) оксид | 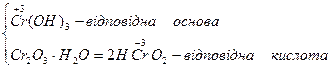
|
З розглянутого матеріалу можна зробити такі висновки:
1) метали в залежності від іх валентності утворюють основні, амфотерні та кислотні оксиди,
2) неметали утворюють тільки кислотні оксиди та декілька несолетворних оксидів, а саме: CO, SіО, N2O, NO.
3) валентність та ступінь окиснення елементів в гідроксидах, які відповідають оксидам, залишаються незмінними.
|
|
Дата добавления: 2015-05-23; Просмотров: 1402; Нарушение авторских прав?; Мы поможем в написании вашей работы!