
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хімічна термодинаміка. Хімічна термодинаміка вивчає: І) енергетичні ефекти реакцій, 2) можливість, напрямок та межу перебігу реакцій
|
|
|
|
РОЗДІЛ ІІ. ЗАКОНОМІРНОСТІ ПЕРЕБІГУ ХІМІЧНИХ РЕАКЦІЙ
Хімічна термодинаміка вивчає: І) енергетичні ефекти реакцій, 2) можливість, напрямок та межу перебігу реакцій.
Розглянемо поняття, які застосовують у хімічній термодинаміці.
Система - це речовина або декілька речовин, що відокремлені від зовнішнього середовища реальною або уявною межою.
Стан системи характеризується:
– параметрами стану: тиск, об`єм, температура, склад системи тощо;
– функціями стану, які залежать лише від кінцевого та початкового станів, а не від шляху перебігу процесів: ентальпія Н, ентропія S, енергія Гіббса G тощо.
Хімічні реакції відбуваються за сталих тиску або об'єму. Переважна більшість хімічних реакцій відбуваються за сталого тиску. Такі умови перебігу реакції називають ізобарними.
Ентальпія Н характеризує енергетичний стан системи, а зміна ентальпії DН – зміну енергетичного стану системи під час перебігу реакції за ізобарних умов.
Під час перебігу хімічних реакцій енергія може виділятися у вигляді теплової, світлової, електричної та механічної енергії. Так, горіння сірки відбувається з виділенням тепла. Окиснення білого фосфору на повітрі супроводжується виділенням енергії у вигляді світла. Під час вибуху суміші водню та кисню енергія системи перетворюється на теплову та механічну. Перетворення енергії окисно-відновних реакцій на електричну спостерігається у гальванічних елементах. Реакції, які відбуваються з виділенням енергії, називаються екзотермічними. Внаслідок іх перебігу ентальпія системи зменшується. І навпаки, реакції можуть відбуватися з поглинанням різних видів енергії, наприклад, розклад сполук за нагрівання, при ударі, під дією електричного струму (електроліз), за освітлення (фотоліз AgBr) тощо. Реакції, які відбуваються з поглинанням енергії і супроводжуються збільшенням ентальпії системи, називаються ендотермічними.
Кількість енергії, що виділяється або поглинається під час перебігу реакцій за сталих тиску та температури, називається тепловим ефектом реакцій.
За першим законом термодинаміки "енергія не виникає з нічого та не зникає безслідно. Різні види енергії взаємно перетворюються в еквівалентних кількостях." Отже, під час перебігу екзотермічних реакцій ентальпія системи зменшується на величину, що дорівнює кількості виділеної енергіі. Під час перебігу ендотермічних реакцій збільшення ентальпіі системи дорівнює кількості енергіі, що поглинається. Таким чином, тепловий ефект реакціі дорiвнюе зміні ентальпії системи DН і вимірюється у кілоджоулях. Теплові ефекти реакцій, які відбуваються за стандартних умов (Т=298К, р=101,3 кПа), називають стандартними і позначають DН0.
Знак DН залежить від співвідношення ентальпій вихідних речовин та продуктів реакцій. Якщо ентальпія продуктів реакції нижча, ніж ентальпія вихідних речовин, то реакція є екзотермічною, тобто відбувається з виділенням енергії і ентальпія системи зменшується (DН<0). Якщо ентальпія продуктів реакції більша, ніж ентальпія вихідних речовин, то реакція є ендотермічною, тобто відбувається з поглинанням енергії і супроводжуються збільшенням ентальпії системи (DН>0).
Розділ термодинаміки, що кількісно вивчає теплові ефекти реакцій, називається термохімією. Рівняння хімічних реакцій, в яких через кому зазначають їх теплові ефекти, називають термохімічними.
Оскільки теплові ефекти реакцій залежать від агрегатного стану речовин, то в термохімічних рівняннях реакцій буквами позначають агрегатний стан речовин: г - газ, р - рідина, т - тверда речовина, к - кристал.
Коефіцієнти в термохімічних рівняннях реакцій вказують на кількості речовин, що беруть участь в реакціях. Наприклад, за термохімічним рівнянням реакції
N2(г) + 3H2(г) = 2NH3(г), ∆H0 = –92 кДж
І моль азоту взаємодіє з 3 моль водню з утворенням 2 моль аміаку і при цьому виділяється кількість енергії 92 кДж.
Коефіцієнти в термохімічних рівняннях реакцій можуть бути дробовими. Наприклад, термохімічне рівняння реакції утворення аміаку можна записати так:
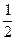 N2(г) +
N2(г) +  H2(г) = NH3(г), ∆H0 = –46 кДж (5.1)
H2(г) = NH3(г), ∆H0 = –46 кДж (5.1)
Оскільки абсолютну величину ентальпії визначити неможливо, то за нуль прийнято вважати ентальпію простих речовин, що за стандартних умов перебувають у стійкому стані.
Стандартний тепловий ефект реакції утворення кількості речовини 1 моль з простих речовин, що перебувають у стійкому стані, називають стандартною ентальпією утворення речовини, позначають теж ∆H0, але поряд у дужках вказують формулу цієі речовини. Стандартні ентальпії утворення речовин вимірюються у кДж/моль. Так, стандартний тепловий ефект реакції (5.1), тобто стандартний тепловий ефект реакції утворення 1 моль NH3 з простих речовин N2 та Н2 є стандартною ентальпією утворення аміаку і дорівнює:
∆H0(NH3)= – 46 кДж/моль.
Стандартні ентальпії утворення стійких за цих умов простих речовин дорівнюють нулю. Наприклад, нулю дорівнює стандартна ентальпія утворення молекулярного кисню О2, а не озону 03; графіту, а не алмазу; рідкого брому Вr2, а не газуватого, тому що саме кисень, графіт та рідкий бром є простими речовинами, які знаходяться за стандартних умов у стійкому стані:
∆H0 (О2(г)) = 0, ∆H0 (C(графіт)) = 0, ∆H0 (Br2(р)) = 0.
А на перетворення кисню на озон, графіту на алмаз, брому з рідкого у газуватий стан потрібна витрата енергії. Так, під час утворення І моль озону з молекулярного кисню поглинається кількість енергії 142 кДж:
 О2(г) = О3(г) , ∆H0 = 142 кДж.
О2(г) = О3(г) , ∆H0 = 142 кДж.
Отже, стандартна ентальпія утворення озону дорівнює:
∆H0 (О3(г)) = 142 кДж/моль,
Стандартні ентальпії утворення речовин наведені в термодинамічних довідниках.
Термохімічні розрахунки грунтуються на законі Гесса та його наслідках. Закон Гесса формулюється так:
"Тепловий ефект реакції не залежить від шляху її перебігу, тобто від числа та характеру проміжних стадій, а залежить лише від початкового та кінцевого станів системи, тобто від природи та агрегатного стану (кристалічноі модифікації твердої речовини) продуктів реакції та вихідних речовин".
На графіку наведені ентальпії утворення вихідних речовин, продуктів реакціі та тепловий ефект певної ендотермічної реакції:
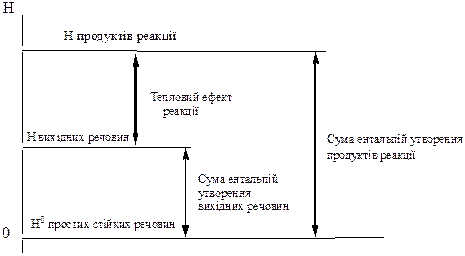
З цього графіку можна зробити висновок, який є наслідком закона Гесса: "Стандартний тепловий ефект реакції дорівнює різниці між сумою стандартних ентальпій утворення продуктів реакції і сумою стандартних ентальпій утворення вихідних речовин, помножених на коефіцієнти у термохімічному рівнянні реакції."
Отже, для реакції
aA + bB = cC + dD
тепловий ефект DН° дорівнює:
DН° = [d·DН°(D)+c·DН°(C)] – [a·DН°(A)+b·DН°(B)] (5.2)
За цим виразом можна розрахувати як тепловий ефект будь-якої реакції, так і ентальпію утворення однієї з речовин, якщо відомі тепловий ефект реакції та ентальпії утворення інших речовин.
Крім того, із закону Гесса випливає такий наслідок:
"Тепловий ефект зворотної реакції дорівнює тепловому ефекту прямої реакції, але з протилежним знаком."
Частковим виразом цього наслідку є закон Лавуазьє-Лапласа:
"Тепловий ефект розкладу кількості хімічної сполуки 1 моль на прості речовини дорівнює ентальпії утворення цієї сполуки, але з протилежним знаком".
Наприклад, стандартна ентальпія утворення НІ дорівнює:
DН°(HI)=26 кДж/моль.
Тобто реакція утворення 1 моль НІ з простих речовин є ендотермічною і супроводжується поглинанням енергії:
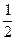 H2 +
H2 + 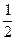 I2 = HI, DН°= 26 кДж.
I2 = HI, DН°= 26 кДж.
А реакція розкладу 1 моль НІ на прості речовини є екзотермічною:
HI = 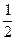 H2 +
H2 + 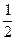 I2, DН° = – 26кДж
I2, DН° = – 26кДж
Ентропія S характеризує ступінь невпорядкованості системи. Чим більший ступінь невпорядкованості системи, тим більша її ентропія.
Під час перетворення твердої речовини за нагрівання у рідину, рідини у газ ступінь невпорядкованості речовини збільшується і її ентропія зростає. І навпаки, за зниження температури відбувається конденсація, а потім кристалізація речовини, ентропія речовини зменшується і згідно з постулатом Планка "за температури 0 К ентропія чистої індивідуальної речовини, що існує у вигляді ідеального кристалу, дорівнює нулю". Виходячи з цього, можна обчислити абсолютні значення ентропії речовини за різних температур. У термодинамічних довідниках наведені значення стандартних ентропій, обчислених за температури 298 К, які відносять до І моль речовини, позначають S°, у дужках вказують формулу речовини і вимірюють у Дж/(моль·К).
Зміна стандартної ентропії системи під час перебігу реакції
аА + вВ = сС + dD
дорівнює різниці між сумою стандартних ентропій продуктів реакції і сумою стандартних ентропій вихідних речовин, помножених на коефіцієнти у рівнянні реакції:
DS°=[d·S°(D)+c·S°(C)]–[a·S°(A)+b·S°(B)] (5.3)
Ентропія дає змогу зробити висновок про можливість перебігу процесів в ізольованій системі. Ізольована система не обмінюється енергією із зовнішнім середовищем. Наприклад, якщо з'єднати між собою дві посудини: одна - з гелієм, інша - з аргоном, то змішування газів відбувається довільно і цей процес не супроводжується ні виділенням, ні поглинанням енергії. У змішаному стані ступінь невпорядкованості системи збільшується і ентропія зростає. Зворотний процес довільно не відбувається, тобто гази довільно у власні посудини не повертаються. Отже, всі процеси в ізольованій системі відбуваються у напрямку збільшення ступеня невпорядкованості системи, тобто у напрямку зростання її ентропії.
Термодинамічна умова перебігу процесів в ізольваній системі -зростання ентропії системи: DS > 0.
Межою перебігу процесів в ізольованій системі є стан рівноваги, в якому її ентропія досягає максимального значення і перестає змінюватись:
S = max, DS = 0
Розглянуті положення об'єднує другий закон. термодинаміки:
"Ентропія ізольованої системи у будь-яких процесах не може зменшуватись“:
DS ³ 0
Але переважна більшість хімічних реакцій супроводжується виділенням (DН<0) або поглинанням (DН>0) енергії, тобто відбуваються в неізольованій системі. І в цих випадках можливість перебігу хімічних реакцій визначається зміною не ентропії, а енергії Гіббса.
Енергія Гіббса G - це частина ентальпії системи Н, яка може бути використаною на виконання корисної роботи Aк. Максимальна корисна робота реакції, що відбувається за сталих тиску та температури, дорівнює зменшенню енергії Гіббса:
Aк = – DG
Отже, хімічні реакції відбуваються у напрямку виконання корисної роботи, тобто у напрямку зменшення енергії Гіббса системи.
Термодинамічна умова перебігу реакцій в неізольованій системі -зменшення енергіі Гіббса системи:
DG < 0.
Межою перебігу реакцій в неізольованій системі є стан рівноваги, в якому енергія Гіббса досягає мінімального значення і перестає змінюватись:
G = min, DG = 0
Оскільки абсолютну величину енергіі Гіббса, як і ентальпіі визначити неможливо, то за нуль приймають енергію Гіббса простих речовин, що перебувають за стандартних умов у стійкому стані. Стандартну зміну енергії Гіббса, яка супроводжує реакцію утворення кількості речовини 1 моль з простих речовин, що перебувають у стійкому стані, називають стандартною енергією Гіббса утворення речовини, позначають DG° (формула речовини) і вимірюють у кДж/моль. Стандартні енергії Гіббса утворення простих речовин, що перебувають у стiйкому станi, дорiвнюють нулю.
Знаючи значення стандартних енергій Гіббса утворення речовин, які наведені в термодинамічних довідниках, можна розрахувати зміну стандартної енергії Гіббса реакції аА + вВ = сС + dD:
DG° = [d·DG°(D)+c·DG°(C)] – [a·DG°(A)+b·DG°(B)] (5.4)
Отже, якщо DG<0, то довільно відбувається пряма реакція, а якщо DG>0, то довільно за цих умов відбувається зворотна реакція. Зміни енергії Гіббса, ентальпії та ентропії реакції зв'язані рівнянням:
DG = DH – TDS (5.5)
Приклад 1. Під час взаємодії алюмінію масою 8,1 г з хлором виділяється кількість енергії 209,25 кДж. Складіть термохімічне рівняння реакції та розрахуйте стандартну ентальпію утворення алюміній хлориду.
Розв`язання.
Згідно з рівнянням реакції:
2Al (т) + 3Cl2 (г) = 2AlCl3 (т),
її тепловий ефект дорівнює кількості енергії, що виділяється під час взаємодії кількості алюмінію 2 моль з хлором.
Визначимо кількість алюмінію масою 8,1 г (1.7):
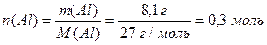
Складаємо пропорцію:
- під час взаємодії 0,3 моль Al виділяється кількість енергії 209,25 кДж,
а під час взаємодії 2 моль Al --------------- x кДж.
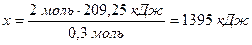
Термохімічне рівняння цієї реакції має такий вигляд:
2Al (т) + 3Cl2 (г) = 2AlCl3 (т), DH0 = –1395 кДж.
Розрахуємо стандартну ентальпію утворення алюміній хлориду.
Стандартний тепловий ефект реакції утворення 2 моль AlCl3 становить DH0 = – 1395 кДж, а стандартний тепловий ефект утворення 1 моль AlCl3, тобто стандартна ентальпія утворення алюміній хлориду дорівнює:
DH0(AlCl3) = 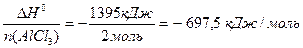
Приклад 2. Термохімічне рівняння реакції згоряння метану:
CH4(г) + 2O2(г) = CO2(г) + 2H2O(р), DH0 = – 878 кДж.
Розрахуйте кількість енергії, що виділяється під час згоряння метану об¢ємом 4,48 л (н.у.).
Розв`язання.
Розрахуємо кількість метану об`ємом 4,48 л (1.7):
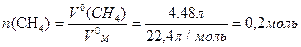
Під час згоряння 1 моль CH4 виділяється кількість енергії 878 кДж,
а під час згоряння 0,2 моль CH4 --------------- х кДж,
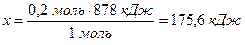
Приклад 3. Розрахуйте стандартний тепловий ефект реакції:
Fe2O3(т) + 3CO (г) = 3CO2(г) + 2Fe(т).
Розв`язання.
Для розрахунку стандартного теплового ефекту реакції за наслідком закону Гесса (5.2) використовуємо значення стандартних ентальпій утворення речовин, наведених в таблиці Д.2, беручи до уваги, що DH0(Fe) = 0:
DН° = 3·DН°(CO2) – DН°(Fe2O3) – 3·DН°(CO) =
= 3моль·(-393,5кДж/моль)–1моль·(-822,2кДж/моль)–3моль·(-110,5кДж/моль) = – 26,8 кДж.
Термохімічне рівняння реакції має такий вигляд:
Fe2O3(т) + 3CO (г) = 3CO2(г) + 2Fe(т), DН° = – 26,8 кДж.
Приклад 4. Виходячи з термохімічного рівняння реакції:
3CaO(т) + P2O5 (т) = Ca3(PO4)2(т), DН° = – 739 кДж,
розрахуйте стандартну ентальпію утворення кальцій оксиду.
Розв`язання.
Згідно з наслідком закону Гесса (5.2) тепловий ефект цієї реакції дорівнює:
DН° = DН°(Ca3(PO4)2) – 3·DН°(CaO) – DН°(P2O5).
Користуючись значеннями стандартних ентальпій утворення кальцій ортофосфату та фосфор (V) оксиду (Табл. Д.2), розрахуємо значення стандартної ентальпії утворення кальцій оксиду:
3·DН°(CaO) = DН°(Ca3(PO4)2) – DН°(P2O5) – DН° =
= 1 моль · (- 4137,5 кДж/моль) – 1 моль · (-1492 кДж/моль) – (-739 кДж) =
= – 1906,5 кДж.
DН°(CaO) = - 1906,5 кДж / 3 моль = - 635,5 кДж/моль
Приклад 5. Використовуючи значення стандартних енергій Гіббса утворення речовин, наведених в таблиці Д.3, розрахуйте DG° реакції та визначте напрямок її перебігу:
8Al(т) + 3Fe3O4(т) = 9Fe(т) + 4Al2O3(т)
Розв`язання.
Розрахуємо DG° реакції, враховуючи, що DG°(Al)=0 та DG°(Fe)=0 (5.4):
DG° = 4 · DG°(Al2О3) – 3 · DG°(Fe3O4) =
= 4 моль · (-1582 кДж/моль) – 3 моль · (-1014 кДж/моль) = – 3285,4 кДж.
Оскільки DG° < 0, то за стандартних умов відбувається пряма реакція.
Приклад 6. Розрахуйте зміну ентропії DS° реакції:
TiO2(т) + 2C(графіт) = Ti(т) + 2CO(г), DН° = 722,9 кДж
Використовуючи рівняння, яке зв`язує зміни енергії Гіббса, ентальпії та ентропії, обчисліть зміну енергії Гіббса реакції за стандартних умов та зробіть висновок про можливість її перебігу.
Розв`язання.
Використовуючи значення стандартних ентропій речовин, наведених в таблиці Д.4, розрахуємо зміну стандартної ентропії реакції (5.3):
DS° = S°(Ti) + 2 · S°(CO) – S°(TiO2) – 2 · S°(C(графіт)) =
=1 моль·30,6Дж/(моль·К) + 2 моль·197,5Дж/(моль·К) –
– 1 моль·50,3Дж/(моль·К) – 2 моль·5,7Дж/(моль·К) = 363,9 Дж/К
Обчислюємо значення DG° реакції (5.5), враховуючи, шо DН° вимірюється у кДж, DS° – у Дж/К, а Т=298К:
DG° = DН° – ТDS° = 722,9 кДж – 298 К · 363,9 ·10-3кДж/К = 614,46 кДж.
Оскільки DG° > 0, відновлення тітан (IV) оксиду TiO2 графітом за стандартних умов неможливо.
Аналіз рівняння, що пов`язує DG, DH та DS
Термодинамічною умовою довільного перебігу реакції є зменшення енергії Гіббса: DG < 0. Зміна енергії Гіббса пов'язана зі змінами ентальпії та ентропії рівнянням:
DG = DH – TDS
Знак зміни енергії Гіббса DG визначається співвідношенням ентальпійного (DH) та ентропійного (TDS) факторів. Аналізуючи наведене рівняння, можна встановити, за яких температурних умов можлива та чи інша реакція.
За низьких температур модуль ентальпійного фактора більший, ніж модуль ентропійного фактора: |DH|>|TDS|. Тому за низьких температур можливість перебігу реакції визначається ентальпійним фактором: DG<0, якщо DН<0, тобто реакція відбувається у напрямку зменшення ентальпії системи незалежно від того, зростає чи зменшується ентропія. Отже, за низьких температур довільно відбуваються у більшості екзотермічні реакції.
За високих температур (Т>1000 К) модуль ентропійного фактора більший, ніж модуль ентальпійного фактора: |TDS|>|DH|. Тому можливість перебігу реакції за високих температур визначається ентропійним фактором: DG<0, якщо DS>0, тобто реакція відбувається у напрямку зростання ентропії системи. Знак зміни ентальпії DH не має значення: за високих температур відбуваються як екзотермічні, так і ендотермічні реакції.
За будь-яких температур можливий перебіг реакції, яка супроводжується зменшенням ентальпії (DH<0) та зростанням ентропії (DS>0) одночасно. У цьому випадку зміна енергії Гіббса за будь-яких температур – величина від'ємна: DG<0. Така реакція є необоротною, тому що зміна енергії Гіббса зворотної реакції за будь-яких температур – величина додатна: DG>0.
Вплив температури на напрямок перебігу реакції
Якщо під час перебігу реакції ентропія системи збільшується (DS>0), то згідно з рівнянням
DG = DH – TDS

підвищення температури Т зменшує енергію Гіббса і тому сприяє перебігу реакції.
Якщо ентропія системи під час перебігу реакції зменшується (DS<0), то, аналізуючи рівняння
DG = DH – TDS,

можна зробити висновок, що підвищення температури збільшує енергію Гіббса і перешкоджає перебігу реакції. Отже, така реакція відбувається лише за низьких температур, коли |DH|>|TDS|, а сама реакція є екзотермічною: DH<0.
Приклад 7. Аналізуючи рівняння, яке пов`язує зміни енергії Гіббса, ентальпії та ентропії, зробіть висновок, підвищення чи зниження температури сприятиме перебігу реакції:
C (т) + Н2O (г) = CO (г) + H2 (г), DH0 > 0.
Розв`язання.
Через те, що одна з вихідних речовин знаходиться у твердому стані, а кількість газуватих продуктів реакції (1 моль СО та 1 моль Н2) більша, ніж кількість газуватих вихідних речовин (1 моль Н2О), кінцевий стан системи є більш невпорядкованим. Оскільки ентропія характеризує ступінь невпорядкованості системи, то реакція супроводжується збільшенням ентропії (DS>0).
Згідно з рівнянням:
DG = DH – TDS

енергія Гіббса зменшується (DG<0) тільки за температур, коли модуль ентропійного фактора стає більшим, ніж модуль ентальпійного фактора: │TDS│>│DH│. Отже, підвищення температури сприяє перебігу реакції. Залежність DG від температури наведена на графіку. Реакція відбувається (DG<0) за температур, вищих за температури рівноважного стану системи Т1, коли DG = 0.
DG
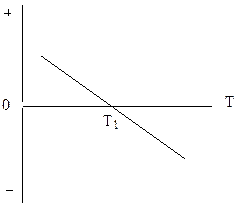
Приклад 8. Аналізуючи рівняння, яке пов`язує зміни енергії Гіббса, ентальпії та ентропії, визначте напрямок перебігу реакції:
N2 (г) + 2O2 (г) = 2NO2 (г), DH0 > 0.
Розв`язання.
Кількість газуватих продуктів реакції (2 моль NO2) менша, ніж кількість газуватих вихідних речовин (1 моль N2 та 2 моль O2). Тому кінцевий стан системи характеризується меншим ступенем невпорядкованості, тобто і меншою ентропією. Отже, зміна ентропії прямої реакції – величина від`ємна. А якщо DH>0, а DS<0, то, згідно з рівнянням:
DG = DH – TDS
за будь-яких температур DG>0. Тому перебіг прямої реакції термодинамічно неможливий. Таким чином, реакція відбувається у зворотному напрямку, тому що для зворотної реакції DH<0, DS>0 і за будь-яких температур DG<0. Залежність DG прямої (а) та зворотної (б) реакцій від температури наведена далі.
DG DG

Приклад 9. Аналізуючи рівняння, яке пов`язує зміни енергії Гіббса, ентальпії та ентропії, визначте, екзо- чи ендотермічною є реакція, яка відбувається довільно: CO (г) + 2H2 (г) = CH3OH (р). Які температури: високі чи низькі – сприяють перебігу реакції?
Розв`язання.
Вихідні речовини – гази, а продуктом реакції є рідина, тому кінцевий стан системи характеризується меншим ступенем невпорядкованості і реакція супроводжується зменшенням ентропії (DS<0). Оскільки реакція відбувається довільно, то DG<0. Згідно з рівнянням:
DG = DH – TDS

енергія Гіббса реакції зменшується (DG<0), якщо зменшується ентальпія системи (DH<0), а модуль ентальпійного фактора більший, ніж модуль ентропійного: │DH│>│TDS│.
Отже, ця реакція є екзотермічною і відбувається за низьких температур (Т<Т1). Це випливає з графіка, на якому наведена залежність DG реакції від температури.
DG

|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 2958; Нарушение авторских прав?; Мы поможем в написании вашей работы!