
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хімічна кінетика
|
|
|
|
Хімічна кінетика та рівновага
Хімічна кінетика – це розділ хімії, який вивчає швидкість хімічних реакцій.
При розгляді питання про швидкість реакцій необхідно розрізняти гомогенні та гетерогенні реакції.
Гомогенні реакції відбуваються в гомогенній, тобто однофазній системі. Прикладом гомогенної системи є суміш газуватих речовин або розчин декількох речовин у воді. В кожному з цих випадків система складається тільки з однієї фази: в першому випадку – з газової фази, а в другому – з рідкої.
Гетерогенні реакції відбуваються в гетерогенній системі, яка складається з двох або більше фаз. Прикладом гетерогенної реакції є згоряння вугілля або корозія металів у водному розчині. В обох випадках система складається з двох фаз: в першому випадку – з твердої та газуватої, в другому – з твердої та рідкої.
Середньою швидкістю гомогенної реакції називається зміна концентрації будь-якої речовини (або вихідної, або утвореної внаслідок реакції) за одниницю часу:
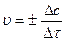 , (6.1)
, (6.1)
де υ – швидкість реакції, 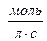 , Dс – зміна концентрації речовини у моль/л за проміжок часу Dt, с.
, Dс – зміна концентрації речовини у моль/л за проміжок часу Dt, с.
Концентрація кожної з вихідних речовин з часом зменшується (Dс<0), а кожного з продуктів реакції – збільшується (Dс>0). Знак “-” у формулі (6.1) ставлять в тому випадку, якщо швидкість реакції визначають за зміною концентрації однієї з вихідних речовин, тому що швидкість реакції може бути тільки додатною, незважаючи на зменшення концентрації вихідних речовин.
Оскільки швидкість реакції весь час змінюється, то в хімічній кінетиці розглядають поняття “дійсна” швидкість реакції, тобто швидкість реакції у даний момент часу, що визначається як перша похідна від концентрації речовини за часом:
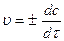 , (6.2)
, (6.2)
де dc – зміна концентрації речовин, якщо dt → 0.
Швидкість гомогенної реакції залежить:
– від концентрації реагуючих речовин, сі;
– якщо реагуючі речовини – газуваті, то від загального тиску газової суміші р та парціального тиску окремих її компонентів рі;
– від природи реагуючих речовин;
– від температури Т;
– від наявності каталізатора.
Необхідною умовою взаємодії між частинками реагуючих речовин є їх зіткнення. Чим більша концентрація реагуючих речовин, тим частіше відбуваються зіткнення між їх частинками, тим вищою є швидкість реакції.
Залежність швидкості гомогенної реакції від концентрації реагуючих речовин відображає закон діючих мас:
“ За сталої температури швидкість хімічної реакції прямо пропорційна добутку концентрацій реагуючих речовин, взятих у степенях, які дорівнюють коефіцієнтам в рівнянні реакції ”.
Вираз, що зв’язує швидкість реакції з концентрацією реагуючих речовин, називається кінетичним рівнянням реакції.
Для гомогенної реакції, що відбувається за рівнянням:
аА + bВ = сС + dD,
кінетичне рівняння має такий вигляд:
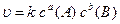 , (6.3)
, (6.3)
де с(А), с(В) – концентрації реагуючих речовин А та В, моль/л,
k – коефіцієнт пропорційності, який називається константою швидкості реакції.
Якщо реагуючі речовини газуваті, то їх концентрацію можна замінити парціальним тиском, тобто тиском окремих компонентів газової суміші:
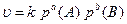 (6.4)
(6.4)
Фізичний зміст константи швидкості реакції:
Константа швидкості реакції чисельно дорівнює швидкості реакції, якщо концентрація кожної з реагуючих речовин становить 1 моль/л:
 c(A)=1моль/л
c(A)=1моль/л
c(B)=1моль/л k= υ
Константа швидкості реакції не залежить від концентрації реагуючих речовин, а якщо реагуючі речовини газуваті, то і від їх парціального тиску, але залежить, як і сама швидкість реакції, від їх природи, температури та наявності каталізатора.
Швидкість гетерогенної реакції, яка відбувається між речовинами, що перебувають у різних фазах, наприклад, між твердою та газуватою речовинами, або між твердою речовиною та речовиною у розчині, залежить відповідно від концентрації лише газуватої речовин або концентрації розчиненої речовини у розчині.
Крім того, через те, що гетерогенні реакції здійснюються на поверхні поділу між фазами, то їх швидкість залежить і від площі цієї поверхні S: чим більше площа поверхні, тим вищою є ймовірність зіткнень частинок, що перебувають у різних фазах, тим більша швидкість їх взаємодії.
Для гетерогенної реакції, яка відбувається за рівнянням:
аА(т) + bB(г) = сС(г) + dD(г),
кінетичне рівняння має вигляд:
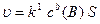 ,
,
де с(В) – концентрація газуватої речовини,
S – площа поверхні поділу між твердою та газуватою фазами.
За умови незмінної площі поверхні (S=const), наприклад, за умови незмінного ступеня подрібненості твердої речовини, кінетичне рівняння можна записати так:
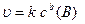 , де
, де 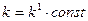 (6.5)
(6.5)
Не кожне зіткнення частинок реагуючих речовин є ефективним, тобто призводить до утворення продуктів реакції. Тому зіткнення частинок реагуючих речовин є необхідною, але недостатньою умовою для початку хімічної реакції.
Енергетичні схеми
а) екзотермічної реакції б) ендотермічної реакції
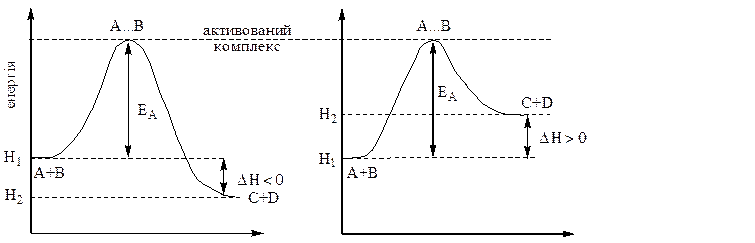
На наведених вище енергетичних схемах Н1 – це середній рівень енергії вихідних речовин А і В, Н2 – середній рівень енергії продуктів реакції С і Д, а різниця (Н2 - Н1) дорівнює тепловому ефекту реакції.
Для того, щоб вихідні речовини перетворилися на продукти реакції, вони мають подолати енергетичний бар’єр, висота якого називається енергією активації реакції, позначається ЕА і вимірюється у кДж/моль.
Отже, енергія активації реакції – це надлишкова, порівняно із середньою, енергія, яку повинні мати реагуючі частинки, щоб їх зіткнення призвело до утворення продуктів реакції.
Енергія активації витрачається на подолання сил відштовхування між електронними оболонками реагуючих частинок та на послаблення старих хімічних зв’язків, тобто міжатомних зв’язків у складі вихідних речовин.
Такі частинки, енергія яких є достатньою для здійснення реакції, називаються активними. Зіткнення тільки між активними частинками є ефективними. Таким чином, швидкість реакції прямопропорційна частці активних частинок:
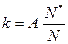 , (6.6)
, (6.6)
де N – загальне число частинок, N* – число активних частинок, а 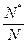 – частка активних частинок.
– частка активних частинок.
В ході реакції з активних частинок реагуючих речовин утворюється проміжне угруповання, яке називається активованим комплексом. В цьому угрупованні старі зв’язки вже послаблені, а нові, тобто зв'язки між атомами в продуктах реакції, тільки починають виникати. Через те, що енергія активованого комплексу максимальна, він є нестійким, існує дуже короткий час і розкладається з утворенням продуктів реакції.
Чим менша величина енергії активації реакції, тим більшою є частка активних частинок, тобто частинок, здатних подолати енергетичний бар’єр, отже, вищою є і швидкість реакції.
Залежність швидкості реакції від величини енергії активації відображає рівняння Арреніуса:
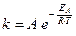 , (6.7)
, (6.7)
де k – константа швидкості реакції,
А – передекспоненціальний множник,
R – універсальна газова стала (8,31·10-3 кДж/(моль×К))
Т – температура, К,
ЕА – енергія активації, кДж/моль.
Фізичний зміст множника А: Величина А дорівнює константі швидкості реакції, якщо ЕА=0, тобто у разі відсутності енергетичного бар’єру.
В цьому випадку всі реагуючі частинки є реакційно здатними, тобто активними, і всі їх зіткнення – ефективні. Тому величина константи швидкості є максимально можливою:
А=kmax (6.8)
З виразів (6.6), (6.7) та (6.8) випливає:
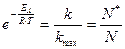 (6.9)
(6.9)
де k та kmax – це відповідно фактична та максимально можлива швидкості реакції за умовою, що концентрації реагуючих речовин становлять 1моль/л, а величина 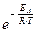 дорівнює частці активних частинок.
дорівнює частці активних частинок.
Таким чином, величина А в рівнянні Арреніуса повинна відповідати загальному числу зіткнень частинок реагуючих речовин Z в одиниці об’єму за одиницю часу. Але значення k, обчислене за рівнянням (6.7), перевищує фактичне значення константи швидкості реакції. Це пояснюється тим, що для хімічної взаємодії реагуючих частинок потрібна певна сприятлива їх орієнтація. Вплив просторової орієнтації реагуючих частинок на швидкість реакції враховує стеричний фактор Р:
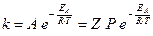 (6.10)
(6.10)
Найчастіше невеликі значення стеричного фактору Р відповідають реакціям між складними за своєю структурою частинками.
Величина енергії активації є таким фактором, через який позначається вплив природи реагуючих речовин на швидкість реакції, а саме:
– для реакцій між молекулами з міцними ковалентними зв’язками характерні високі значення енергії активації (ЕА=150¸450 кДж/моль). Лише невелика частка зіткнень між ними є ефективною. Тому такі реакції відбуваються повільно;
– енергія активації йонних реакцій невелика (ЕА=0¸80кДж/моль). Йонні реакції відбуваються практично миттєво, тому що не потребують витрати енергії на подолання сил відштовхування між протилежно зарядженими йонами.
Залежність швидкості реакції від температури визначається приблизним правилом Вант-Гоффа: “За підвищення температури на кожні 10 градусів швидкість більшості реакцій зростає у 2-4 рази”.
Математично ця залежність виражається таким співвідношенням:
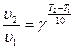 , (6.11)
, (6.11)
де υ2 і υ1 – швидкості реакції відповідно за температури Т2 і Т1,
g - температурний коефіцієнт швидкості реакції.
Температурний коефіцієнт швидкості реакції показує, у скільки разів збільшується швидкість реакції за підвищення температури на 10 градусів.
Вплив температури на швидкість реакції можна пояснити на прикладі взаємодії між молекулами газуватих речовин. На малюнку наведено розподілення молекул газу в залежності від їх кінетичної енергії за температур Т1 та Т2. Максимум на кривих розподілу відповідає частці молекул, енергія яких є середньою (Есер.).
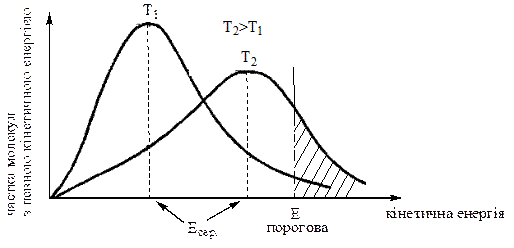
Вся площа під кривою дорівнює загальному числу молекул N. Але ефективними є зіткнення тільки активних молекул, тобто молекул, енергія яких перевищує певну порогову енергію E, необхідну для утворення активованого комплекса. Отже, площа заштрихованої ділянки дорівнює числу ативних молекул N*.
За температури T1 таку енергію, як показано на малюнку, має лише невелика частка молекул. Тому реакція відбувається повільно. Але, якщо значення порогової енергії E мало відрізняється від середньої, тоді число молекул, які мають необхідну енергію, значно більше. В цьому випадку реакція відбувається з дуже великою швидкістю, тобто практично миттєво.
За підвищення температури до T2 вся площа під кривою, тобто і загальне число молекул залишаються незмінними, але енергія між молекулами перерозподіляється так, що число активних молекул збільшується пропорційно площі заштрихованої ділянки. Отже, за підвищення температури частка активних молекул 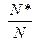 зростає, внаслідок чого збільшується швидкість реакції.
зростає, внаслідок чого збільшується швидкість реакції.
Але найбільш ефективним методом прискорення хімічних реакцій є використання каталізаторів.
Каталізатором називається речовина, яка, приймаючи участь в реакції, збільшує швидкість реакції, але в результаті її перебігу не витрачається.
Розрізняють гомогенний та гетерогенний каталіз.
У випадку гомогенного каталізу каталізатор та реагуючі речовини утворюють одну фазу – газувату або рідку.
Нижче наведений у загальному вигляді один з механізмів гомогенного каталізу.
Якщо реакція за рівнянням:
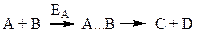
без каталізатора відбувається повільно, то у присутності каталізатора вона проходить через такі стадії:
– спочатку каталізатор (К) утворює з однією з вихідних речовин проміжну сполуку АК:
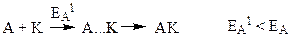
– потім ця сполука взаємодіє з іншою вихідною речовиною і каталізатор при цьому вивільняється:
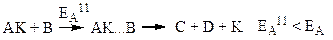
Отже, у присутності каталізатора виникають активовані комплекси за участю каталізатора, утворення яких потребує меншої енергії активації, ніж утворення активованих комплексів у відсутності каталізатора. Тому частка активних частинок, здатних подолати цей нижчий енергетичний бар’єр, зростає, що призводить до збільшення швидкості реакції.
При гетерогенному каталізі каталізатор та реагуючі речовини знаходяться у різних фазах: як правило, каталізатор – тверда речовина, а реагуючі речовини – гази або рідини.
У цьому випадку на поверхні каталізатора відбувається адсорбція, тобто поглинання каталізатором частинок реагуючих речовин, внаслідок чого збільшується їх поверхнева концентрація. Це зумовлює прискорення реакції. Крім того, під дією каталізатора послаблюються зв'язки між атомами в частинках реагуючих речовин і, як і у випадку гомогенного каталізу, утворюються проміжні сполуки каталізатора з реагуючими речовинами, які потребують меншої енергії активації, ніж у відсутності каталізатора. Тому швидкість реакції значно зростає.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 1713; Нарушение авторских прав?; Мы поможем в написании вашей работы!